
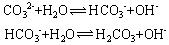 可知[HCO3-]<[OH-],因此D不正确。
可知[HCO3-]<[OH-],因此D不正确。 

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
 2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:
2NH3(g),在一定条件下,向VL密闭容器中加入xmolN2,ymol H2进行反应,经过2min后测得NH3zmol,用N2、H2、NH3表示的反应速率分别是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com