
 .
.  新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
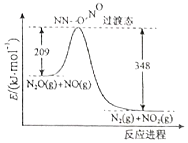 请完成下列问题
请完成下列问题| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、K+、OH-、NO3-、CO32-、SO42-.为了进一步确认,对该溶液进行实验检测:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ③⑤⑥ | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 苏打 | 纯净空气 | CaCO3 | 干冰 |
| B | 碘酒 | 漂白粉 | NH3•H20 | Fe |
| C | 明矾 | 铝合金 | 石墨 | 醋酸 |
| D | 盐酸 | CuSO4•5H2O | Na2SO4 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g O3含有的氧原子数目为2NA | |
| B. | 5.6 g的Fe在足量Cl2中完全燃烧转移电子数为0.2NA | |
| C. | 0.1 mol•L-1 Na2SO4溶液含有的钠离子数目为0.2NA | |
| D. | 标准状况下,22.4 L苯含有的碳原子数目为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| 弱酸 | HNO2 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | Ki=5.1×10-4 | Ki=2.98×10-8 | $\begin{array}{l}{K_{i1}}=4.3×{10^{-7}}\\{K_{i2}}=5.6×{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54×{10^{-2}}\\{K_{i2}}=1.02×{10^{-7}}\end{array}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
Ⅰ.某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com