
| 实 验 方 案 | 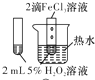 | 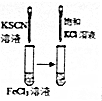 | 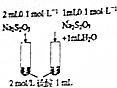 | 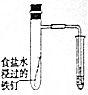 |
| 目 的 | A.验证升高温度可加快H2O2分解 | B.探究增大c(Cl-使平衡逆向移动 | C.探究浓度对化学反应速率的影响 | D.验证铁发生析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.只有温度一个变量;
B.只改变浓度一个变量;
C.硫代硫酸钠、硫酸的阴离子、阳离子均不相同;
D.食盐水呈中性.
解答 解:A.只有温度一个变量,则图中装置可验证升高温度可加快H2O2分解,故A正确;
B.只改变浓度一个变量,则图中装置可验证增大反应物浓度对平衡的影响,故B正确;
C.硫代硫酸钠、硫酸的阴离子、阳离子阳离子均不相同,不能比较浓度对化学反应速率的影响,也可能与阴离子有关,故C错误;
D.食盐水呈中性,发生吸氧腐蚀,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重影响化学反应速率的影响因素及金属腐蚀的考查,把握化学反应原理、实验技能为解答的关键,注意实验的评价性分析及控制变量法的应用,题目难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X | |
| B. | X、Z两元素能形成原子个数比(X:Z)为3:1的化合物 | |
| C. | 化合物YW2、ZW2都是酸性氧化物 | |
| D. | 用M单质作阳极,石墨作阴极,电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,VL水含有的氧原子个数为$\frac{V}{22.4}$NA | |
| B. | CO2通过Na2O2使其增重bg时,反应中转移的电子数为bNA/44个 | |
| C. | 常温下,1L 1 mol•L-1的乙酸溶液中,所含CH3COO-为NA | |
| D. | 常温常压下,0.1 mol氖气含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 埋在潮湿土壤里的铁管比在干燥土壤中的更易被腐蚀 | |
| B. | 在空气中,金属镁、铝的表面可形成一层氧化膜 | |
| C. | 为保护海轮的船壳,常在海轮上镶嵌锌块 | |
| D. | 镀锡的铁制品,镀层部分破坏后,露出的铁表面更容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | Cl2O3 | D. | ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 充电时,LiFePO4既发生氧化反应又发生还原反应 | |
| C. | 该电池不能用水溶液作为电解质 | |
| D. | 放电过程中Li+向负极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com