
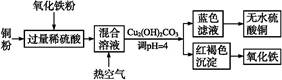
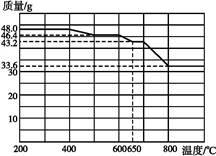
 CuSO4+SO2↑+2H2O 产生有污染的气体
CuSO4+SO2↑+2H2O 产生有污染的气体 2Fe3++3H2O、2Fe3++Cu
2Fe3++3H2O、2Fe3++Cu 2Fe2++Cu2+(或Fe2O3+Cu+6H+
2Fe2++Cu2+(或Fe2O3+Cu+6H+ 3H2O+2Fe2++Cu2+)
3H2O+2Fe2++Cu2+) 4F
4F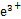 +2H2O 加热、蒸发
+2H2O 加热、蒸发

科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 | 若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 | |
| 步骤3:去步骤2得到少量固体与试管中,滴加 | |
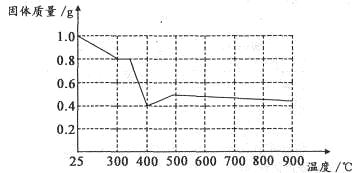
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
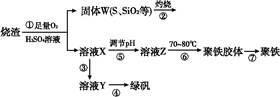
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔点比生铁的低 |
| B.与相同浓度的盐酸反应生成氢气的速率比生铁的快 |
| C.在冷的浓硫酸中可以钝化 |
| D.在潮湿空气中比生铁容易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
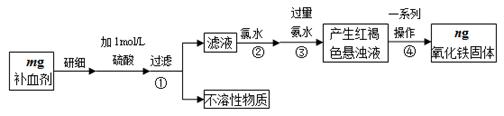
| A.KSCN溶液 | B.酸性KMnO4溶液 | C.铁粉 | D.FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cu + SO2
2Cu + SO2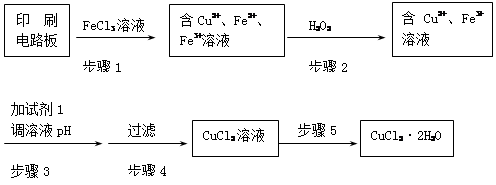
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com