
有一块铁的“氧化物”样品,用140 mL 5.0 mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
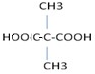 .
.查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:填空题
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1) ①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
(2)②中所发生的各反应的化学方程式是_______________________。
(3)③中所发生的各反应的离子方程式是_________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: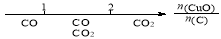
B.Fe在Cl2中的燃烧产物: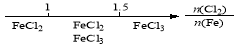
C.AlCl3溶液中滴加NaOH后铝的存在形式: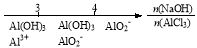
D. 氨水与SO2反应后溶液中的铵盐:
氨水与SO2反应后溶液中的铵盐: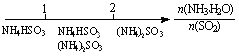
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上第二次适应性考试化学卷(解析版) 题型:选择题
某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4 B.HCl C.NaOH D.NaNO3
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
标准状况下,向1 00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
00 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是

A. b点水的电离程度比c点水的电离程度大
B.氢硫酸的酸性比亚硫酸的酸性强
C.原H2S溶液的物质的量浓度为0.05 mol·L-1
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验所用试剂或操作 | 实 验 现 象 | 验证的性质 |
| 碘化钾淀粉溶液 | ||
| 取适量过氧化氢溶液于试管中,加热,用带火星的木条检验. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com