
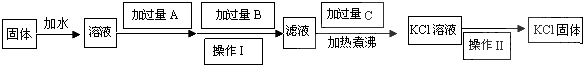
分析 利用MgCl2和MgSO4能与所提供的溶液中的Ba(OH)2溶液形成Mg(OH)2沉淀、BaSO4沉淀而被除去,因此可先向混合溶液中加入足量或过量的Ba(OH)2溶液,待充分反应后过滤,所得滤液为KCl溶液与过量Ba(OH)2溶液的混合溶液;接下来利用加入过量K2CO3的方法再把多余的Ba(OH)2反应而除去,此时过滤后的溶液为KCl溶液、KOH溶液及过量的K2CO3溶液的混合溶液;然后利用KOH、K2CO3与HCl反应生成KCl采取滴加适量稀HCl到不再放出气泡时,得到的溶液即为纯净的KCl溶液,最后经蒸发结晶可得到氯化钾晶体,以此解答该题.
解答 解:利用MgCl2和MgSO4能与所提供的溶液中的Ba(OH)2溶液形成Mg(OH)2沉淀、BaSO4沉淀而被除去,因此可先向混合溶液中加入足量或过量的Ba(OH)2溶液,待充分反应后过滤,所得滤液为KCl溶液与过量Ba(OH)2溶液的混合溶液;接下来利用加入过量K2CO3的方法再把多余的Ba(OH)2反应而除去,此时过滤后的溶液为KCl溶液、KOH溶液及过量的K2CO3溶液的混合溶液;然后利用KOH、K2CO3与HCl反应生成KCl采取滴加适量稀HCl到不再放出气泡时,得到的溶液即为纯净的KCl溶液,最后经蒸发结晶可得到氯化钾晶体,
(1)由以上分析可知A为Ba(OH)2,B为K2CO3,C为盐酸,故答案为:Ba(OH)2;K2CO3;盐酸;
(2)A为氢氧化钡,氢氧化钡可以将MgCl2、MgSO4中的镁离子和硫酸根离子除去,加入过量氢氧化钡,可使镁离子和硫酸根离子完全生成沉淀而除去,加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2或反应生成的BaCl2完全反应而除去,反应后加入盐酸除去KOH、K2CO3,加热煮沸,可除去HCl,操作Ⅰ为过滤操作,用于分离沉淀和溶液,操作Ⅱ为物质的溶液获得晶体的方法,为蒸发结晶,
故答案为:除尽Mg2+和SO42-;除尽过量的Ba2+; 使过量的HCl挥发;过滤、蒸发.
点评 本题考查分离、提纯实验方案的设计,为高频考点,把握实验流程及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂不能引入新杂质,题目难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:实验题
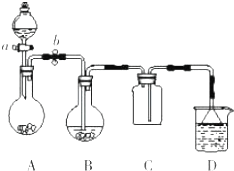 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
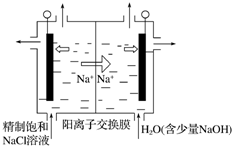 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯混合气体中的原子数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
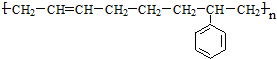

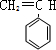 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$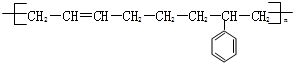 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3是还原剂,其中N元素被氧化 | |
| B. | 生成物中的N2是氧化产物,K2O是还原产物 | |
| C. | 当氧化产物比还原产物多2.8g时,转移电子$\frac{1}{14}$ mol | |
| D. | 氧化剂与还原剂的物质的量之比5:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com