
离子方程式H+ + OH-= H2O可表示的化学方程式是( )
A.盐酸与氢氧化铜的反应 B.硫酸氢钠与氢氧化钠的反应
C.硫酸与氢氧化镁的反应 D.盐酸与氨水的反应
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A. ⑥③①②⑤④ B. ⑤①②⑥④③ C. ⑤④③②①⑥ D. ③①②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,溶液中的金属离子不可能是( )
A.仅有Fe2+ B.有Cu2+ 、Fe2+ 和Fe3+
C.仅有Cu2+ 和Fe2+ D.仅有 Fe3+ 和Fe2+
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:填空题
(10分) 现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
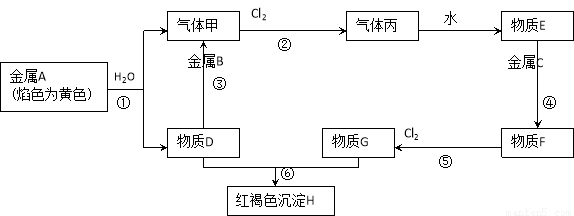
请回答下列问题:
(1)写出下列物质的化学式:B 、丙
(2)写出下列反应的化学方程式:
反应① ;反应③ ;
反应⑥ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
某温度下,w克某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w克。在①H2 、②CO、 ③CO和H2的混合气、④C6H12O6中( )
A.均不符合 B.只有①② C.只有①②③ D.全部符合
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
对于反应:3S+6NaOH=2Na2S+Na2SO3+3H2O, 以下说法正确的是( )
A.该反应既属于四种基本类型的反应,又属于氧化还原反应
B.氧元素被还原,硫元素被氧化
C.每有3 mol S参加反应转移6 mol电子
D.S既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去)。请按要求回答下列问题:
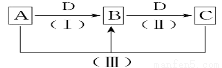
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为__________________________。
(2)若A常用作制冷剂,B和D为空气的主要成分,则反应(Ⅲ) 的化学方程式为______________。
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式可以是_________________________。
(4)若D为酸或酸性气体,则A、B、C、D可以是________________(请按顺序写出合理的答案)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
X、Y、Z和M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,Z极上有H2放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高一下学期期末考试化学试卷(解析版) 题型:实验题
下图为制取乙酸乙酯的实验装置图。回答下列问题:
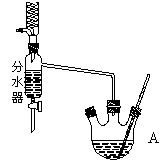
揭示实验原理
乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯。请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式______________________。
能否用氢同位素示踪法揭示酯化反应原理? _______(选填“能”或“不能”),原因是___________________。
反应温度确定:
合成乙酸乙酯的反应为放热反应。实验表明,反应温度应控制在85℃左右为宜。回答:
实验温度不宜低于85℃左右的原因是__________________________________________;
实验温度不宜高于85℃左右的原因是__________________________________________;
实验装置的比较:
利用右图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是___________。
酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴____试液,现象是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com