
设NA为阿伏加德罗常数,下列叙述中正确的是( )
|
| A. | 标准状况下,2.24LCH4所含质子数为0.1NA |
|
| B. | 0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
|
| C. | 0.1mol C8H18分子中共价键总数为2.5NA |
|
| D. | 100mL 1mol/L醋酸溶液中离子总数为0.2NA |
| 阿伏加德罗常数.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | A、依据n= B、铁和氯气反应生成氯化铁; C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键; D、醋酸是弱电解质存在电离平衡. |
| 解答: | 解:A、依据n= B、铁和氯气反应生成氯化铁,0.1mol Fe与足量氯气反应转移的电子数为0.3NA,故B错误; C、C8H18分子属于烷烃,结合烷烃分子结构计算所含共价键=0.1mol(18+8﹣1);×NA=2.5NA,故C正确; D、醋酸是弱电解质存在电离平衡,100mL 1mol/L醋酸溶液中离子总数小于0.2NA,故D错误; 故选C. |
| 点评: | 本题考查了阿伏伽德罗常数的分析判断,主要是气体摩尔体积计算,分子结构的理解应用,弱电解质电离平衡的判断,掌握基础是关键,题目较简单. |


科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水。其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)
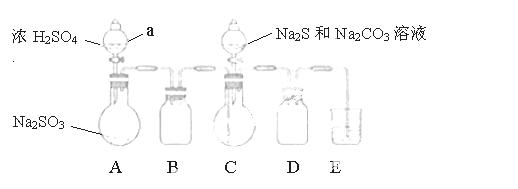
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是____;E中的试剂是___(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合液,滤液经____(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成的Na2SO4的量,在不改变原有装置的基础上对原有实验步骤(2)进行了改进,改进后的操作是_______。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过_____方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列物质的化学性质,判断其应用错误的是( )
|
| A. | 酒精能使蛋白质变性,可用于杀菌消毒 |
|
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 |
|
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 |
|
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列化学反应的离子方程式是( )
|
| A. | 用碳酸钠溶液吸收少量二氧化硫:2CO32﹣+SO2+H2O=2HCO3﹣+SO32﹣ |
|
| B. | 金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
|
| C. | 硫化钠溶于水中:S2﹣+2H2O=H2S↑+2OH﹣ |
|
| D. | 碳酸镁溶于硝酸中:CO32﹣+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
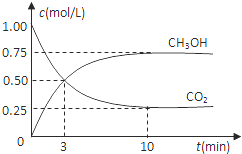
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min).
②该反应的平衡常数表达式为 k= .
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH﹣﹣4e﹣=O2↑+2H2O,则阴极反应式为: .
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反 应中,既属于氧化还原反应又属于吸热反应的是( )
应中,既属于氧化还原反应又属于吸热反应的是( )
A. 氢氧化钾与硫酸的反应
B. 高温煅烧石灰石
C. 高温条件下碳粉与氧化铜的反应
D. 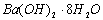 晶体与NH4Cl固体的反应
晶体与NH4Cl固体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(结构如下图)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是
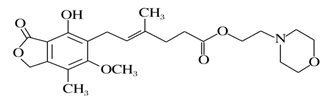
A. 霉酚酸酯能溶于水
B. 霉酚酸酯能与浓溴水发生取代反应
C. 1 mol霉酚酸酯能与含4 mol NaOH的水溶液完全反应
D. 霉酚酸酯既可以催化加氢,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com