
分析 根据M=ρVm计算烃的摩尔质量,结合C的质量分数计算C原子数目,结合相对分子质量计算H原子数目,可得烃的分子式,书写可能的结构简式.
解答 解:烃的摩尔质量为3.214g/L×22.4L/mol=72g/mol,即相对分子质量为72,分子中C原子数目为$\frac{72×83.3%}{12}$=5,则H原子数目为$\frac{72-12×5}{1}$=12,故烃的分子式为C5H12,
可能的结构简式有:CH3CH2CH2CH2CH3,名称为戊烷,CH3CH2CH(CH3)2,名称为2-甲基丁烷,C(CH3)4,名称为2,2-二甲基丙烷,
答:烃的分子式为C5H12,可能的结构简式有:CH3CH2CH2CH2CH3,名称为戊烷,CH3CH2CH(CH3)2,名称为2-甲基丁烷,C(CH3)4,名称为2,2-二甲基丙烷.
点评 本题考查有机物分子式确定、同分异构体书写、烷烃的命名,比较基础,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再变化 | |
| B. | 混合气体的颜色不变化 | |
| C. | 混合气体中NO2、NO、O2的物质的量之比为2:2:1 | |
| D. | 单位时间生成2n mol NO,同时消耗2n mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 | c(CO)/mol/L | c(H2)/mol/L | c(CH3OH)/mol/L |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能是降低温度 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “水滴石穿”是溶解了CO2的雨水与CaCO3的长期作用,生成了可溶性的Ca(HCO3)2 | |
| B. | 新型水处理剂高铁酸钠(Na2FeO4),因为具有强氧化性,所以能对水进行消毒,同时,还原产物能形成带电的氢氧化铁胶体,能使水中的杂质沉降而达到净水的目的 | |
| C. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可以缓解白色污染 | |
| D. | 如果人觉察到室内煤气浓度较高的时候,应该将头尽量贴地,匍匐行进至门口或者窗口,不要急着打开电灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的还原性:X>M | |
| B. | Z、M元素最高价氧化物的水化物均为强酸 | |
| C. | X与Y简单离子半径:r(X离子)<r(Y离子) | |
| D. | 化合物ZX2与ZN4含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
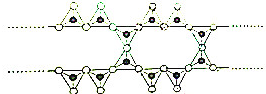 在结构中,
在结构中,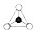 表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.
表示硅氧四面体(SiO4),则该结构式的通式为(Si6O17)n10n-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
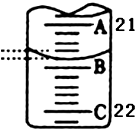 为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
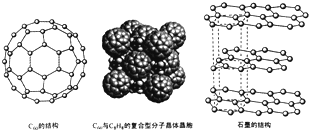 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题: .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com