
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
【答案】(1)CaCl2或BaCl2(合理答案均可)
(2)①CaCO3+2H+=Ca2++H2O+CO2↑②检查装置的气密性③否
④2Na2O2+2CO2=2Na2CO3+O2;2Na2O2+2H2O=4NaOH+O2↑
⑤吸收未反应的CO2⑥a⑦![]() (写出正确表达式未化简也给分)⑧偏小
(写出正确表达式未化简也给分)⑧偏小
【解析】
试题分析:(1)Na2O2易变质,与空气中CO2反应,生成Na2CO3,Na2CO3与BaCl2溶液或Ba(NO3)2溶液等易反应,生成白色BaCO3沉淀,而Na2O2与水反应所得溶液不能与BaCl2溶液或Ba(NO3)2溶液反应;
(2)①A中发生反应离子方程式为CaCO3+2H+ = Ca2++ H2O+CO2↑;
②根据题意,该实验成功的关键是准确测量反应生成氧气的体积,因此必须检查整套装置是否漏气;
③由于需要排水法测量体积,因此B装置出来的气体不需要干燥;
④生成的CO2中含有水蒸气,则装置C中发生的所有反应的化学方程式为2Na2O2+2CO2 = 2Na2CO3+O2、2Na2O2+2H2O = 4NaOH+O2↑。
⑤D中NaOH溶液的作用是吸收未反应的CO2。
⑥a、C中反应是放热反应,产生的氧气温度高于室温,故不冷却读数导致氧气体积偏大,a错误;
b.上下移动量筒,使得E、 F中液面高度相同,b正确;c.视线与凹液面的最低点相平读取量筒中水的体积,c正确,答案选a;
⑦由V/Vm可知n(O2)=![]() ,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2×
,由反应式2CO2+2Na2O2=2Na2CO3+O2可知,n(Na2O2)=2n(O2)=2×![]() ,由nM可知,m(O2)=2×
,由nM可知,m(O2)=2×![]() ×78gmol—1,则样品中Na2O2的质量分数=
×78gmol—1,则样品中Na2O2的质量分数=![]() ×100%=
×100%= ×100%=
×100%=![]() ×100%或
×100%或![]() ;
;
⑧该实验成功的关键是准确测量反应生成氧气的体积,E到F之间导管内水的体积没有办法测量会引起氧气体积减小,测定结果偏小。


科目:高中化学 来源: 题型:
【题目】NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,用离子方程式表示原因_____________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的作用是_________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。向饱和NaClO溶液中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_______________________。
(4)常温下,pH=11的NaClO溶液中,水电离出来的c(OH-)=________,在pH=3的HClO溶液中,水电离出来的c(H+)=____________________________。
(5)已知纯水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是________(填字母)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(6)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m________n(填“<”、“>”或“=”)。
(7) 在25 ℃时,将0.2 mol NaA晶体和0.1 mol HA气体同时溶解于同一烧杯的水中,制得1 L溶液,则c(HA)+c(A-)= mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠投入滴有酚酞的水中,下列有关实验现象的叙述错误的是
A. 钠沉在水底 B. 钠熔成闪亮小球并在水面四处游动
C. 水溶液变为红色 D. 有气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应的是
A. 2KBr + Cl2=2KCl + Br2 B. CaCO3=CaO +CO2↑
C. SO3 + H2O=H2SO4 D. MgCl2 + 2NaOH=Mg(OH)2↓ + NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,某溶液中由水电离产生的c(H+)和c(OH-)的乘积为1×10-18,则下列说法正确的是
A.该溶液一定是酸性 B.该溶液一定是碱性
C.该溶液的pH可能是7 D.该溶液可能是酸性也可能是碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
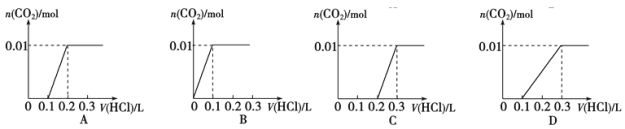
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取粗铜和绿矾(FeSO4·7H2O)产品,设计流程如下:

(1)气体a为________
(2)固体B的主要成分为____________
(3)溶液B在空气中放置有可能变质,如何检验溶液B是否变质:_________________________
(4)下列实验操作中,步骤⑤中需要用到的是________(填字母)。

(5)为测定产品中绿矾的质量分数,称取40.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.80 | 20.02 | 19.98 | 20.00 |
① 请写出有关滴定的离子方程式_____________________
② 第1组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定前尖嘴有气泡,滴定后气泡消失
d.滴定终点时俯视读数
③ 根据表中数据,计算所得产品中绿矾的质量分数为_________(保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com