
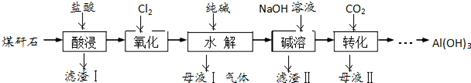
分析 煤矸石溶于稀盐酸发生的反应有Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O、FeO+2H+=Fe2++H2O,然后过滤,得到的滤渣为SiO2,向滤液中通入氯气,发生的反应为2Fe2++Cl2=2Cl-+2Fe3+,向溶液中加入碳酸钠,发生的反应为3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑、Fe3++3H2O?Fe(OH)3+3H+,过滤得到的滤液中含有NaCl,向滤渣中加入过量NaOH溶液,Al(OH)3溶解,其余沉淀不溶解,过滤后得到的滤渣II为Fe(OH)3,滤液中含有NaAlO2,向滤液中通入二氧化碳,发生的反应为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(或2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-),然后过滤得到Al(OH)3,母液II中含有NaHCO3或碳酸钠,据此分析解答.
解答 解:(1)“酸浸”过程中Al2O3溶解的离子方程式为 Al2O3+6H+=2Al3++3H2O,“酸浸”前常常将煤矸石粉碎,其目的是增大接触面积,加快反应速率,提高浸取率,
故答案为:Al2O3+6H+=2Al3++3H2O;增大接触面积,加快反应速率,提高浸取率;
(2)H2O2氧化Fe2+(酸溶时盐酸过量)的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)检验水解过程中Fe3+已被完全沉淀的方法是:取滤液Ⅰ少许于试管中,滴入KSCN溶液,若溶液不变血红色,则Fe3+已经沉淀完全,
故答案为:滴入KSCN溶液,若溶液不变血红色,则Fe3+已经沉淀完全;
(4)304g煤矸石中,Fe2O3、FeO的质量为304g×10%=30.4g,滤渣II为Fe(OH)3,设FeO的物质的量为xmol,Fe2O3的物质的量为ymol,则有$\left\{\begin{array}{l}{72x+160y=30.4}\\{(x+2y)×107=42.8}\end{array}\right.$,所以x=0.2,y=0.1,所以根据电子得失守恒,将0.2mol的亚铁离子氧化成铁离子需要通入标准状况下的Cl2的物质的量为0.1mol,所以其体积为2.24L,
故答案为:2.24.
点评 本题考查制备实验方案设计,为高考高频点,此种题型涉及物质性质、实验基本操作,明确物质的性质及每一步发生的反应、基本操作方法是解本题关键,熟练掌握元素化合物知识,灵活运用知识解答问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用二氧化硫漂白纸浆、毛、丝、草帽辫等,是因为二氧化硫的还原性能使有色物质被氧化而褪色 | |
| B. | 过氧化钠用于呼吸面具作为氧气的来源,是因为过氧化钠具有强氧化性能氧化二氧化碳 壶水生成氧气 | |
| C. | 向盐碱地(含较多的NaCl、Na2C03)中施加适量石膏,可降低土壤的碱性,是因为石膏能与 Na2C03反应生成CaC03沉淀 | |
| D. | 在被保护的锅炉内壁,装上镁合金或锌块,以减少锅炉的腐蚀,是因为镁、锌比铁活泼,这样连接使锅炉做为原电池的负极被保护下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象 | |
| 甲 | 向Ⅰ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液.连接Ⅰ、Ⅳ,打开活塞 | Ⅰ中剧烈反应,产生无色气体并伴随大量白雾;Ⅳ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入必要的试剂,并向Ⅳ中加入KI、淀粉溶液和稀硫酸.连接Ⅱ、Ⅳ,点燃酒精灯 | Ⅳ中有气泡冒出,溶液变蓝 |
| 操作 | 现象 | |
| 丙 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅳ中加入KI、淀粉溶液并在上层覆盖少量煤油.使Ⅰ中发生反应将装置中空气排尽后,再将气体通入Ⅳ的溶液中 | Ⅳ中有气泡冒出,溶液不变蓝 |
| 丁 | 向Ⅰ中加入Na2CO3和稀硫酸,Ⅲ中加入必要试剂,Ⅳ中加入KI、淀粉溶液.依次连接Ⅰ、Ⅲ、Ⅳ,打开活塞 | Ⅳ中有气泡冒出,溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

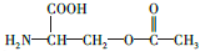 .
. b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com