
【题目】![]() 时,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如图所示。下列说法不正确的是
时,分别向NaA溶液和MCl溶液中加入盐酸和NaOH溶液,混合溶液的pH与离子浓度变化关系如图所示。下列说法不正确的是
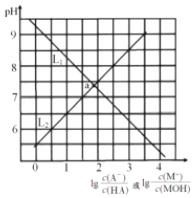
A.![]()
B.![]() 点时两溶液中水的电离程度相同
点时两溶液中水的电离程度相同
C.曲线![]() 表示
表示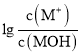 与pH的变化关系
与pH的变化关系
D.![]() 溶液中存在:
溶液中存在:![]()
【答案】B
【解析】
NaA溶液中加入盐酸,溶液pH逐渐减小,![]() 逐渐减小,
逐渐减小,![]() 逐渐增大,则
逐渐增大,则 的值逐渐减小,则曲线
的值逐渐减小,则曲线![]() 表示
表示 与pH的关系;MCl溶液中加入NaOH溶液,溶液pH逐渐增大,
与pH的关系;MCl溶液中加入NaOH溶液,溶液pH逐渐增大,![]() 逐渐减小,
逐渐减小,![]() 逐渐增大,则
逐渐增大,则 的值逐渐减小,则曲线
的值逐渐减小,则曲线![]() 表示
表示 与pH的变化关系,据此分析解答。
与pH的变化关系,据此分析解答。
A、当 时,此时溶液中
时,此时溶液中![]() ,故A正确;
,故A正确;
B、![]() 点溶液的
点溶液的![]() ,溶液呈碱性,对于曲线
,溶液呈碱性,对于曲线![]() ,由于
,由于![]() 离子水解导致溶液呈碱性,促进水电离;曲线
离子水解导致溶液呈碱性,促进水电离;曲线![]() 中,MCl溶液呈酸性,a点呈碱性,说明加入NaOH溶液生成的MOH的电离程度大于
中,MCl溶液呈酸性,a点呈碱性,说明加入NaOH溶液生成的MOH的电离程度大于![]() 离水解程度,抑制水电离,所以两种溶液中水的电离程度不同,故B错误;
离水解程度,抑制水电离,所以两种溶液中水的电离程度不同,故B错误;
C、根据以上分析知,曲线![]() 表示
表示 与pH的变化关系,故C正确;
与pH的变化关系,故C正确;
D、曲线![]() 中,
中, 时,
时, ,
,![]() ,根据
,根据![]() 可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度
可知,电离平衡常数越大,对应离子的水解程度越小,则水解程度![]() ,则MA溶液呈碱性,则
,则MA溶液呈碱性,则![]() ,根据电荷守恒得
,根据电荷守恒得![]() ,其水解程度较小,所以存在
,其水解程度较小,所以存在![]() ,故D正确;
,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示。下列叙述中,正确的是
A.该反应的化学方程式为![]()
B.若![]() ,则反应开始至
,则反应开始至![]() 时间段M 的反应速率为
时间段M 的反应速率为![]()
C.![]() 时正逆反应速率相等,反应达到平衡状态
时正逆反应速率相等,反应达到平衡状态
D.![]() 时正反应速率等于逆反应速率
时正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
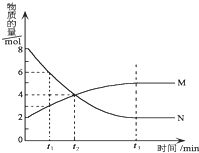
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )
A. Ksp[Cu(OH)2]的数量级为10-20
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
C. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D. 向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1500mol/LNaOH溶液测定某未知浓度的盐酸,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2-3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2-3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写): → →F→ → → →D;___
(2)操作F中应该选择图中滴定管___(填标号)。
![]()
(3)滴定终点的现象是___。
(4)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为___(保留4位有效数字)。
(5)下列操作会导致测定结果偏高的是___。
A.用酸式滴定管向锥形瓶中放盐酸时,先仰视后平视读数
B.锥形瓶用盐酸润洗
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)已知若c(NH4Cl)<0.1mol·L-1,则pH>5.1,常温下若用0.1mol·L-1盐酸滴定10mL0.05mol·L-1氨水,甲基橙作指示剂,达到终点时所用盐酸的量应是___5mL(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 某放热反应能自发进行,则该反应一定是熵增的反应
B. 0.1 mol·L-1 CH3COONa溶液与0.05 mol·L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(CH3COOH)>c(Cl-)>c(H+)
C. pH相等的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl三种溶液中,c(NH4+)大小:①>③>②
D. 某温度时水的离子积常数KW=10-12,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=9∶11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法中不正确的是( )
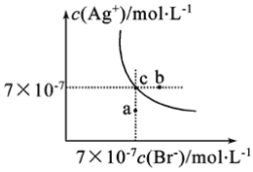
A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
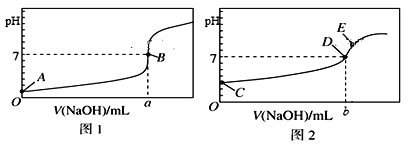
(1)滴定盐酸的曲线是图__________(填“1”或“2”)。
(2)滴定前CH3COOH的电离度为__________( ![]() )。
)。
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”);若图中E点pH=8,则c(Na+)-c(CH3COO-)的精确值为__________mol/L。
(4)若同pH同体积的下列溶液:①醋酸溶液;②盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _______________(填序号)。
Ⅱ.重金属离子会对河流和海洋造成严重污染。某化工厂废水(pH=2.0,ρ=1 g/mL)中含有
Ag+、Pb2+等重金属离子,其浓度约为0.01 mol/L,排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S |
Ksp | 8.3×1012 | 5.6×108 | 6.3×1050 |
难溶电解质 | PbI2 | Pb(OH)2 | PbS |
Ksp | 7.1×109 | 1.2×1015 | 3.4×1028 |
(1)你认为往废水中加入________(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8,处理后废水中c(Pb2+)=_____。
(3)如果用食盐处理只含Ag+的废水,测得处理后的废水(ρ=1 g/mL)中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1×108mol/L,问该工厂处理后的废水中Ag+是否符合排放标准? _______已知Ksp(AgCl)=1.8×1010。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A. 甲基环己烷的一氯代物有4种
B. 甲苯(C7H8)和甘油(C3H8O3)二者以任意比例混合,当总质量一定时,充分燃烧生成水的质量是不变的
C. 某烃的结构简式可表示为![]() (碳原子数≤10),已知烃分子中有两种化学环境 不同的氢原子,则该烃一定是苯的同系物
(碳原子数≤10),已知烃分子中有两种化学环境 不同的氢原子,则该烃一定是苯的同系物
D. 分子式为C5H10O2的有机物只能含有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式(或离子方程式)说明:
盐碱地产生碱性的原因:______________________________;
(2)请用离子方程式表示明矾净水的原理:_______________________
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n(填“>”“<”或“=”)。
(4)25℃时,将amol·L-1氨水与0.01mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”)。
(5)如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是_____________。
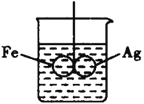
A.铁圈和银圈左右摇摆不定 B.铁圈和银圈保持平衡状态
C.铁圈向下倾斜,银圈向上倾斜 D.银圈向下倾斜,铁圈向上倾斜
写出银圈上的电极反应式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com