
| A. | 用新制的Cu(OH)2可鉴别乙醛、乙酸、乙醇 | |
| B. | 除去乙烷中少量乙烯:光照条件下通入Cl2,气液分离 | |
| C. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| D. | 除去苯中混有的苯酚:向混合液中加入过量的NaOH溶液,充分反应后分液 |
分析 A.乙醛、乙酸、乙醇分别与新制的Cu(OH)2混合的现象为砖红色沉淀、蓝色溶液、无现象;
B.光照下乙烷与氯气发生取代反应;
C.乙酸与CaO反应后,增大与乙醇的沸点差异;
D.苯酚与NaOH反应后,与苯分层.
解答 解:A.乙醛、乙酸、乙醇分别与新制的Cu(OH)2混合的现象为砖红色沉淀、蓝色溶液、无现象,现象不同,可鉴别,故A正确;
B.光照下乙烷与氯气发生取代反应,将原物质除去,不能除杂,应选溴水、洗气,故B错误;
C.乙酸与CaO反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故C正确;
D.苯酚与NaOH反应后,与苯分层,然后分液可分离,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的鉴别、混合物分离提纯,把握物质的性质、混合物分离方法及原理等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②⑤⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
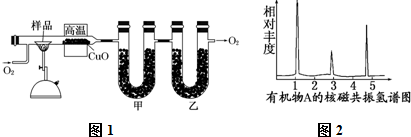
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10℃时pH=12的Na0H溶液与40℃时pH=12的Na0H溶液中:c(OH-)相等 | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)═c(NH4+) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | 向10mLpH=12的Na0H溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、Cl- | B. | K+、Cu2+、SO42- | C. | Cl-、NO3-、Mg2+ | D. | Ba2+、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
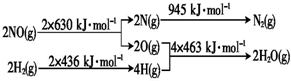
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
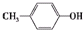 ;③
;③ ;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦
;④CH3CH2Cl;⑤CCl4;⑥CH≡CH;⑦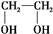 ;⑧CH3CH2OH
;⑧CH3CH2OH| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com