

 )就是其中的一种.
)就是其中的一种. 分析 (1)由苯和氯气生产氯苯的反应是苯中的H被Cl取代,为取代反应,化学反应为C6H6+Cl2$\stackrel{Fe}{→}$C6H5Cl+HCl;
(2)DDT具有稳定性、脂溶性、药效普适性等特点,DDT中含苯环和-Cl,结合卤代烃的性质来分析;
(3)由A的结构可知,含碳碳双键、-CHO、-OH;
(4)南极企鹅和北极土著居民的体内也曾发现微量的DDT,造成这种情况的主要原因是生物富集、食物链传递、DDT性质较稳定,实验又证实,当初美国加利福尼亚州受污染的达莱湖里大鱼体内脂肪类组织中,据此答题;
(5)化学新农药对环境污染应小,杀毒效果好、药物残留少.
解答 解:(1)由苯和氯气生产氯苯的反应是苯中的H被Cl取代,为取代反应,化学反应为C6H6+Cl2$\stackrel{Fe}{→}$C6H5Cl+HCl,
故选C;
(2)DDT具有稳定性、脂溶性、药效普适性等特点,则能杀死有益的生物,不溶于水,不易分解,DDT中含苯环和-Cl,属于烃的衍生物,
故选B;
(3)由A的结构可知,含碳碳双键、羟基、醛基,
故答案为:碳碳双键、羟基、醛基;
(4)南极企鹅和北极土著居民的体内也曾发现微量的DDT,造成这种情况的主要原因是生物富集、食物链传递、DDT性质较稳定,实验又证实,当初美国加利福尼亚州受污染的达莱湖里大鱼体内脂肪类组织中,
故答案为:生物富集、食物链传递、DDT性质较稳定;脂肪;
(5)为避免或减少污染环境和破坏生态平衡,化学新农药对环境污染应小,杀毒效果好、药物残留少,则新规定为高效、低毒、低残留,
故答案为:高效、低毒、低残留.
点评 本题考查有机物的结构与性质,为高考常见题型,把握信息中物质的结构及苯、卤代烃的性质为解答的关键,注重化学与环境保护、农药使用的关系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3Cl2+6KOH═5KCl+KClO3+3H2O | B. | 2FeBr2+3Cl2═2FeCl3+2Br2 | ||
| C. | SnCl4+2H2O═SnO2+4HCl | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2Cl2 | -77 | 137 | 遇水生成HCl,SO2,S2,300℃以上万全分解: S2Cl2+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2SCl2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是实验室制取溴苯的装置图
如图是实验室制取溴苯的装置图查看答案和解析>>
科目:高中化学 来源: 题型:填空题
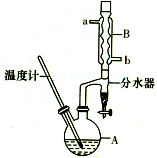 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如图:| 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入适量NH4Cl(s),则混合液中c(NH4+)与c(NH3•H2O)之比增大 | |
| B. | 25℃时,0.1mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1mol•L-1 CH3COOH溶液中,c(CH3COO-)=c(H+) | |
| D. | 向0.1mol•L-1KNO3溶液中,滴加稀盐酸至溶液pH=5,此时混合液中c(K+)<c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com