

| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
分析 该分子中含有碳碳双键、苯环和酯基,具有烯烃、苯和酯的性质,能发生加成反应、取代反应、水解反应、加聚反应、氧化反应,据此分析解答.
解答 解:A.碳碳双键能被酸性高锰酸钾溶液氧化、也能和溴发生加成反应,故A错误;
B.碳碳双键、苯环能和氢气发生加成反应,1mol阿托酸乙酯最多能与4mol H2加成,故B错误;
C.该分子中含有碳碳双键、苯环和酯基,具有烯烃、苯和酯的性质,能发生加成反应、取代反应、水解反应、加聚反应、氧化反应,故C正确;
D.分子式为C11H12O2,故D错误;
故选C.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查烯烃、苯、酯的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
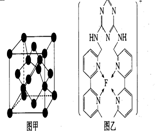 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,且E元素的基态原子有4个未成对电子,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ | |
| B. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.4kJ•mol-1 | |
| D. | CH4+2O2═CO2+2H2O△H=-890.3kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;b 的结构简式
;b 的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
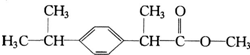 关于有机物X的说法中,错误的是( )
关于有机物X的说法中,错误的是( )| A. | X难溶于水,易溶于有机溶剂 | B. | 1molX能跟4 mol氢气发生加成反应 | ||
| C. | X能使酸性高锰酸钾溶液褪色 | D. | X的水解产物不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 | |
| 步骤1 | 将上述澄清溶液分置于A、B试管中. | |
| 步骤2 | ||
| 步骤3 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) | |
| B. | 2c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) | |
| C. | c(K+)>c(Na+)>c(HCO3-)+c(CO32-)>c(OH-)>c(H+) | |
| D. | c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com