
(14分)下表所示的是第二周期元素中,除Be、B、Ne三种元素外,其它元素的简单氢化物的沸点;题26图所示是第三周期元素中,除Ar以外的其它元素的单质的熔点变化关系。


(1)X的简单氢化物属于 分子(填“极性”或“非极性”),G元素的单质在固态时的晶体类型为___ _。
(2)写出W的氢化物的电子式 ______。
(3)A和Z两元素形成的一种化合物分子中各原子最外均达到8电子稳定结构,则该分子的结构式为 。
(4)化合物AY能与水反应生成两种弱酸,其化学方程式为
(5)写出元素F的单质与三氧化二铬反应的化学方程式___
(1)极性 (2分),原子晶体(2分) (2)Li+[:H]-(2分)
(3) 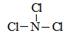 (2分)
(4)ClF+H2O=HClO+HF(3分)
(2分)
(4)ClF+H2O=HClO+HF(3分)
(5)2Al+Cr2O3 Al2O3+2Cr(3分)
Al2O3+2Cr(3分)
【解析】(1)X的氢化物的沸点是100℃,所以X是水,属于极性分子。G单质的熔点最高,应该是单质硅,属于原子晶体。
(2)W的氢化物最高,应该是离子化合物,而在第二周期中能析出离子晶体的是LiH,电子式为Li+[:H]-。
(3)A的熔点最低,应该是氯气。Z的氢化物沸点仅比M的氢化物沸点高,所以Z是氮元素。由于化合物分子中各原子最外均达到8电子稳定结构,所以是NCl3,结构类似于氨气,所以结构式为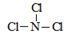 。
。
(4)Y是F,非金属性最强,所以ClF和水反应的方程式为ClF+H2O=HClO+HF。
(5)F单质的熔点仅比硅的底,所以F是铝。发生铝热反应,反应式为2Al+Cr2O3 Al2O3+2Cr。
Al2O3+2Cr。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A(短周期) | B(短周期) | C | D(短周期) |
| 原子最外层上p电子数等于次外层电子数 | 原子最外层有两个未成对电子,其单质为人类生存必须物质 | 单质为生活中常见的金属材料,有紫红色金属光泽 | 单质是常见的半导体材料,广泛应用于IT行业 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
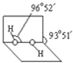 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
查看答案和解析>>
科目:高中化学 来源: 题型:
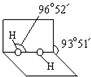 (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
| OH- |
| H+ |
| ||
| H+ |
查看答案和解析>>
科目:高中化学 来源:2012届重庆市高三考前模拟测试理科综合试题化学试卷(带解析) 题型:填空题
(14分)下表所示的是第二周期元素中,除Be、B、Ne三种元素外,其它元素的简单氢化物的沸点;题26图所示是第三周期元素中,除Ar以外的其它元素的单质的熔点变化关系。

(1)X的简单氢化物属于 分子(填“极性”或“非极性”),G元素的单质在固态时的晶体类型为___ _。
(2)写出W的氢化物的电子式 ______。
(3)A和Z两元素形成的一种化合物分子中各原子最外均达到8电子稳定结构,则该分子的结构式为 。
(4)化合物AY能与水反应生成两种弱酸,其化学方程式为
(5)写出元素F的单质与三氧化二铬反应的化学方程式___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com