
| A. | 溶液、胶体、浊液属于不同的分散系 | |
| B. | 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 | |
| C. | 可利用丁达尔现象鉴别溶液和胶体 | |
| D. | 利用过滤的方法可以分离胶体和溶液 |
分析 A.溶液、胶体、浊液分散质粒子的大小不同;
B.分散质粒子的大小不同是分散系的本质区别;
C.溶液无丁达尔效应,胶体有丁达尔效应;
D.胶体和溶液都能透过滤纸.
解答 解:A.分散质微粒直径,小于1nm的形成分散系为溶液,大于100nm为浊液,1-100nm的为胶体,故A正确;
B.分散质粒子的大小不同是分散系的本质区别,分散质微粒直径,小于1nm的形成分散系为溶液,大于100nm为浊液,1-100nm的为胶体,故B正确;
C.丁达尔效应是胶体的独有性质,而溶液物此性质,利用丁达尔效应鉴别胶体和溶液,故C正确;
D.胶体和溶液都能透过滤纸,所以不能用过滤的方法分离胶体和溶液,故D错误.
故选D.
点评 本题考查胶体的性质,题目难度不大,本题易错点为C,注意胶体有介稳性,丁达尔效应是胶体的独有性质.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
 卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途.
卤族元素是典型的非金属元素,卤素单质及其化合物在生产和生活中都有重要的用途. 、
、 、
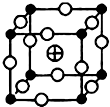
、 分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.
分别代表一种离子),晶胞边长为anm(1nm=10-9m),该晶体的化学式为KMgF3,该晶体的密度为$\frac{0.1993}{{a}^{3}}$g•cm-3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
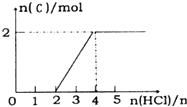 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: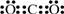 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其单质的电子式为
,其单质的电子式为 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸混合:2H++CO32-═CO2↑+H2O | |
| B. | Al投入NaOH溶液中:Al+OH-+H2O═AlO2-+H2↑ | |
| C. | 亚硫酸钠溶液与稀硫酸混合:2H++SO32-═SO2↑+H2O | |
| D. | 二氧化锰与浓盐酸混合后加热:MnO2+4H++4Cl-═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
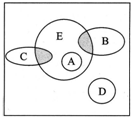 如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
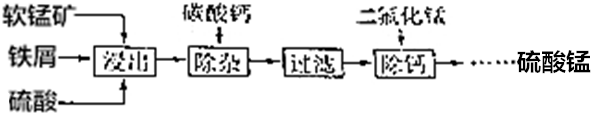
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com