
| ⅠA | ⅡA | ⅢA | IⅤA | ⅤA | ⅤⅠA | ⅤⅡA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
A、乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3+OH-
| ||
B、向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-
| ||
| C、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
D、乙醛溶液与新制氢氧化铜碱性悬浊液共热CH3CHO+2Cu(OH)2+OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
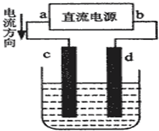 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、电解过程中,c电极发生还原反应 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、常压下五种元素的单质中,Z单质的熔点最高 |
| B、Z2水溶液中通入YO2后褪色,表现了YO2的漂白性 |
| C、工业上合成X的氢化物采用高温高压催化剂条件 |
| D、Y、Z的阴离子电子层结构都与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L H2O 中所含的分子数为0.5NA |
| B、常温下,32g O3中所含的原子数为2NA |
| C、1.0 mol?L-1NaOH溶液中所含Na+离子数为NA |
| D、5.6g Fe与2.24L Cl2充分反应,转移的电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Na+) |
| c(HCO3-) |
| A、①④ | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com