
一定温度下,10mL0.40mol/L H2O2溶液发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min)
B.6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L?min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(7分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,
用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
(1)相同条件下,相等物质的量浓度的NH4Al(SO4)2中c(NH4+) (填“=”、“>”“<”)NH4HSO4中c(NH4+)。
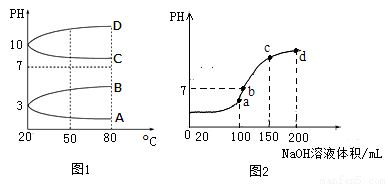
(2)如图1是0.1mol?L﹣1电解质溶液的pH随温度变化的图象。
①其中符合0.1mol?L﹣1 NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母);
②室温时,0.1mol?L﹣1 NH4Al(SO4)2中2c(SO42﹣)﹣c(NH4+)﹣3c(Al3+)= mol?L﹣1(填数值)
(3)室温时,向100mL 0.1mol?L﹣1 NH4HSO4溶液中滴加0.1mol?L﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是 。
几种稀土元素的电离能(单位:kJ·mol-1)
元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为 ,1mol CH2=CH2中含有的σ键数目为 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是 。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有 个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g·cm-3(不必计算出结果)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:填空题
(13分)水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液中,溶液的pH= 。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为 ,由水电离出的c(OH-)= mol·L-1。
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,

则HX是 (填“强酸”或“弱酸”),理由是 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为 (填化学式)。
②25 ℃时,在0.5 mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省武汉市武昌区高三元月调考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.二氧化硅晶体是一种无色透明的固体,常用作光导纤维的材料
B.臭氧是一种有特殊臭味、氧化性极强的淡蓝色气体,可用作餐具的消毒剂
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝比铁更耐酸、碱的腐蚀
D.人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
下列离子方程式不正确的是
A.Cu和浓硫酸在加热条件下的反应:Cu+2H2SO4(浓) Cu2++SO42—+SO2↑+2H2O
Cu2++SO42—+SO2↑+2H2O
B.含氟牙膏防治龋齿的化学原理:Ca5(PO4)3OH+F- Ca5(PO4)3 F + OH-
Ca5(PO4)3 F + OH-
C.用0.100mol·L—1的NaHSO4标准溶液滴定Ba(OH)2溶液,酚酞做指示剂,接近滴定终点时的离子反应:H++OH- H2O
H2O
D.次磷酸(H3PO2)为一元酸,与NaOH溶液反应:H3PO2+OH- H2PO2—+H2O
H2PO2—+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省等五校高三联考理综化学试卷(解析版) 题型:填空题
(16分)Heck反应是偶联反应的一种,例如:反应①:

化合物Ⅰ可以由以下途径合成:

(1)化合物Ⅱ的分子式为 ,1mol该物质最多可与 molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程式为:
(注明条件)。
(3)化合物Ⅳ含有甲基且无支链的同系物Ⅵ的分子式为C4H6O,则化合物Ⅵ的结构简式为: 。
(4)化合物Ⅴ可与CH3CH2OH发生酯化反应生成化合物Ⅶ,化合物Ⅶ在一定条件下可以发生加聚反应,则其加聚产物的结构简式为: 。
(5)化合物Ⅱ的一种同分异构体Ⅷ能发生银镜反应,且核磁共振氢谱只有三组峰,峰面积之比为1:2:2,Ⅷ的结构简式为: 。
(6)一定条件下, 与
与 也可以发生类似反应①的反应,其有机产物的结构简式为: 。
也可以发生类似反应①的反应,其有机产物的结构简式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
制备普通玻璃的主要原料是
A.Na2SiO3 B.CaCO3 C.Na2CO3 D.SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com