
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
【答案】D
【解析】
对比容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入4molSO3等效于在相同条件下反应物投入量为4molSO2和2molO2,容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,p2
2c1,p2![]() 2p1,α1(SO2)+α2(SO3)
2p1,α1(SO2)+α2(SO3)![]() 1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3
1,容器1和容器2温度相同,K1=K2;容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时c3
υ1,升高温度平衡向逆反应方向移动,平衡时c3![]() c1,p3
c1,p3![]() p1,α3(SO2)
p1,α3(SO2)![]() α1(SO2),K3
α1(SO2),K3![]() K1,据此分析可得结论。
K1,据此分析可得结论。
A.容器2中起始反应物物质的量为容器1的两倍,容器2相当于在容器1达平衡后增大压强,将容器的体积缩小为原来的一半,增大压强化学反应速率加快,υ2![]() υ1,增大压强平衡向正反应方向移动,平衡时c2
υ1,增大压强平衡向正反应方向移动,平衡时c2![]() 2c1,故A错误;
2c1,故A错误;
B.由上述分析可得:K3![]() K1,p2
K1,p2![]() 2p1,p3
2p1,p3![]() p1,则p2
p1,则p2![]() 2p3,故B错误;
2p3,故B错误;
C. 容器3相当于在容器1达到平衡后升高温度,升高温度化学反应速率加快,υ3![]() υ1,升高温度平衡向逆反应方向移动,平衡时α3(SO2)
υ1,升高温度平衡向逆反应方向移动,平衡时α3(SO2)![]() α1(SO2),故C错误;
α1(SO2),故C错误;
D.c2![]() 2c1,c3
2c1,c3![]() c1,则c2
c1,则c2![]() 2c3,α1(SO2)+α2(SO3)
2c3,α1(SO2)+α2(SO3)![]() 1,α3(SO2)
1,α3(SO2)![]() α1(SO2),则α2(SO3)+α3(SO2)
α1(SO2),则α2(SO3)+α3(SO2)![]() 1,故D正确;
1,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
技术人员晒制蓝图时,用K3Fe(C2O4)3]·H2O(三草酸合铁酸钾)作感光剂,再以K3[Fe(CN)6]氰合铁酸钾)溶液作显影剂。请回答以下问题:
(1)铁元素在周期表中位置为___________,Fe3+的基态价电子排布图为___________。
(2)在上述两种钾盐中第一电离能最大的元素为___________,电负性最小的元素为___________。
(3)H2C2O4分子屮碳原子的杂化类型是___________,与C2O42-互为等电子体的分子的化学式为___________(写一种)。
(4)在分析化学中F-常用于Fe3+的掩蔽剂,因为生成的FeF63-十分稳定,但Fe3+却不能与I-形成配合物,其原因是______________________(用离子方程式来表示)。
(5)已知C60分子结构和C60晶胞如右图所示:
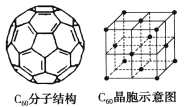
①1个C60分子中含有π键的数目为___________。
②晶胞中C60的配位数为___________。
③已知C60晶胞参数为apm,则该晶胞密度的表达式是___________g·cm-3(NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)现有四种有机物:①乙烯,②2-丙醇,③甲苯,④![]() ,⑤
,⑤![]() ,⑥
,⑥ ,⑦
,⑦![]() ,⑧
,⑧![]() 其中:
其中:
(1)能衡量一个国家的石油化工生产水平的是__________(填序号),该物质可用于制备常用塑料,其反应化学方程式是_______________________。
(2)能用来制取梯恩梯(TNT)的是________(填序号),其发生反应的化学方程式是__________________;
(3)上述有机物能与金属钠发生反应的是_________(填序号),与⑧互为同分异构体的是___________(填序号),⑤与酸性高锰酸钾反应的产物是______________(填结构简式);
(二)实验室用燃烧法测定某固体有机物A的分子组成,测定装置如图所示(铁架台、铁夹、酒精灯等未画出):
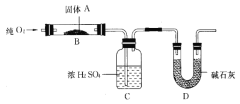
取17.1g A放入B装置中,持续通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题:
(4)D装置的作用是____________________,有同学认为该套装置有明显的缺陷,需要改进,该同学判断的理由是___________________;
(5)装置改进后进行实验,若A的摩尔质量为342g/mol,C装置增重9.9g,D装置增重26.4 g,则A的分子式为_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化①大气固氮②硝酸分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
A.③①②B.②①③C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种光伏材料中间体。工作室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
②![]()
回答下列问题
(1)B所含官能团名称为___________。
(2)由B生成C和E生成F的反应类型分别为___________、___________。
(3)D的结构简式为___________。
(4)由A生成B的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,符合要求的X的结构有___________种,写出其中一种结构简式___________。
(6)根据已有知识并结合相关信息,写出以乙醇为原料合成 CH3CH2CH2COOH的合成路线(无机试剂在用)(合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH ______________________________________________。
CH3CH2OH ______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Ba(OH)2和NaOH混合溶液中缓慢通入CO2至过量(溶液温度变化忽略不计),生成沉淀物质的量与通入CO2体积的关系如下图所示。下列说法不正确的是
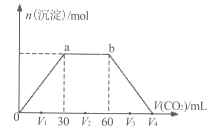
A. b点时溶质为NaHCO3
B. 横坐标轴上V4的值为90
C. V1、V2、V3时,溶液中c(Ba2+)·c(CO32-)相等
D. 原混合物中n[Ba(OH)2]:n(NaOH)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应H2NCOONH4(s)![]() 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①每生成34g NH3的同时消耗44g CO2 ②混合气体的平均相对分子质量不变 ③NH3的体积分数保持不变 ④混合气体的密度保持不变 ⑤c(NH3):c(CO2)=2:1
A. ①③⑤ B. ①③④ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体中原子间通过______________________作用形成面心立方密堆积,其中M原子的配位数____________。
(2)元素Y的含氧酸中,酸性最强的是________________(写化学式),该酸根离子的立体构型为______________________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
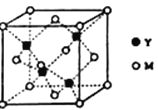
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为__________________________g·cm–3。(只写出计算式,阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和Cl2在一定条件下反应生成PCl5。
(1)有88 g CO2与足量H2恰好完全反应,生成气态水和甲醇,可放出1.2014×105 J的热量,试写出该反应的热化学方程式_______________________________________。
(2)25 ℃、101 kPa下,CH4的燃烧热为a kJ/mol,9 g液态水变为水蒸气吸热b kJ,则CH4燃烧生成二氧化碳和水蒸气热化学方程式为________________________________。
(3)硅与氯两元素的单质反应生成1mol硅的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:________________________________________________。
(4)CO2与CH4经催化重整制得合成气:CH4(g)+ CO2(g) ![]() 2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
2CO (g)+ 2H2(g)已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=________________________________。
(5)利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com