
| A. | 酸性强弱HIO4<HBrO4<HClO4 | B. | 原子半径大小S>Na>O | ||
| C. | 碱性强弱KOH<NaOH<LiOH | D. | 金属性强弱Na<Mg<Al |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大;
C.元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
D.同周期元素从左到右元素的金属性减弱.
解答 解:A.非金属性I<Br<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B.同周期元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,应为Na>S>O,故B错误;
C.金属性K>Na>Li,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故C错误;
D.同周期元素从左到右元素的金属性减弱,应为Na>Mg>Al,故D错误.
故选A.
点评 本题综合考查元素周期律知识,侧重于学生的分析能力的考查,为高频考点,注意把握比较的角度以及相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液 | |
| B. | 电解时,阴极发生氧化反应,则阴极发生的反应为:Cu2++2e-═Cu | |
| C. | 粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥 | |
| D. | 电解铜的纯度可达99.95%~99.98% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
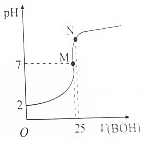 25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )
25℃时,向25mL 0.1000mol•L-1HA溶液滴加同浓度的BOH溶液,混合溶液pH随滴加BOH溶液的变化如下图所示.下列有关叙述错误的是( )| A. | BA溶液呈碱性 | |
| B. | 酸HA的电离常数约为0.0011 | |
| C. | M点时,c(B+)=c(A-)>c(H+)=c(OH-) | |
| D. | N点时加入10mL0.1000mol•L-1HA溶液,将促进A-的水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
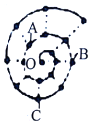 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“.”代表一种元素,其中O点代表氢元素,下列说法中错误的是( )| A. | O与A、B、C均能形成两种化合物 | |
| B. | A元素位于元素周期表ⅥA族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | B、C最高价氧化物的水化物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量稀NaOH溶液 | B. | 加入少量NaNO3固体 | ||
| C. | 加入少量NaHSO4固体 | D. | 加入少量CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na的原子结构示意图: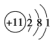 | |
| B. | 含有6个质子和7个中子的碳元素的核素符号:${\;}_{6}^{13}$C | |
| C. | 氮气的电子式::N:::N: | |
| D. | 用电子式表示氧化钠的形成过程: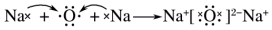 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
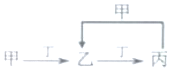 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )| A. | 氢化物的稳定性:Z>Y | B. | 离子半径:Z>Y>X | ||
| C. | W可能是金属元素 | D. | W和X均能与Y形成两种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
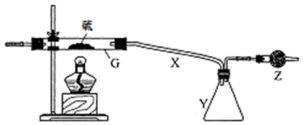
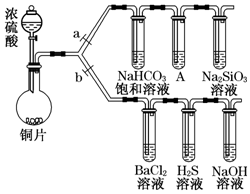 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com