
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | ||
| 第(2)组 | ||
| 第(3)组 |
分析 (1)(1)单质分为气态单质和固体单质;
(2)单质分为金属单质和非金属单质进行解答;
(3)根据氧化物分为金属氧化物和非金属氧化物进行解答;
(2)一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,钠和水的反应中,氢氧化钠是强电解质拆分为离子,其他为单质和弱电解质不写成离子,氢氧化铝和氢氧化钠的反应中,氢氧化铝难溶于水不能拆分为离子,氢氧化钠和偏铝酸钠属于溶于水的强电解质拆分为离子,水为弱电解质不能拆分为离子;
解答 解:(1)(1)O2、F2、S、N2 都是一种元素组成的单质,其中O2、F2、N2 都是气态非金属单质,S为固态非金属单质,
(2)根据物质所属类别,Fe、Na、Al属于金属单质,而Si是非金属单质,
(3)NO、CO2、SO2是非金属氧化物,而CaO是金属单质,
故答案为:
| 组 别 | 被选出的物质 | 挑选依据 |
| 第(1)组 | S | 其他三种为气态单质 |
| 第(2)组 | Si | 其它三种为金属单质 |
| 第(3)组 | CaO | 其它三种为非金属氧化物 |
点评 本题主要考查了物质的分类、反应类型判断、离子方程式书写,根据不同的分类标准,物质分类可有不同的结果,注意离子方程式书写方法的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 将Na投入到CuSO4溶液:2Na+Cu2+═2Na++Cu | |
| C. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| D. | SiO2与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
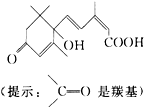
| A. | 含有碳碳双键、羟基、羰基、羧基 | B. | 含有苯环、羟基、羰基、羧基 | ||
| C. | 含有羟基、羰基、羧基、酯基 | D. | 含有碳碳双键、苯环、羟基、羰基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时应先用清水润洗容量瓶 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 振荡分液漏斗时应关闭其玻璃塞和活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 平衡混合气的平均相对分子质量 | |
| B. | 平衡混合气中一种反应物的浓度 | |
| C. | 平衡混合气中一种生成物的体积分数 | |
| D. | 平衡混合气中一种反应物的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
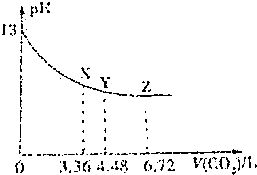
| A. | 该NaOH溶液的浓度为0.1mol/L,体积为6L | |
| B. | X、Y、Z三点对应的溶液中离子的种类不同 | |
| C. | Y点对应的融资中离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y点对应的溶液中存在着:c(Na+)=2c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 | |
| C. | 加水稀释CH3COONa溶液,溶液中的所有离子浓度都减小 | |
| D. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com