
我国科学家最近指出:2050年后全球将出现的四大能源是,①氚和氦-3的核聚变 ②天然气水合物 ③空间太阳能发电 ④氢能。这四大能源未来在提供能量过程中会产生新核素的是( )
A.① B.② C.③ D.④
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。
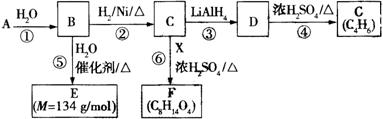
(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式: (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式: 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
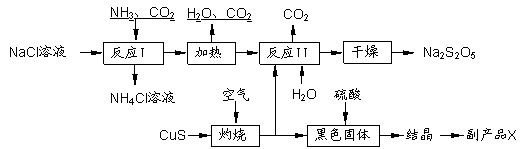 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时 发生反应的化学方程式: 。
发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
①钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等
②K、Na合金可作原子反应堆的导热剂
③发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
④Na2O2既可作呼吸面具中O2的来源,又可漂白织物、麦杆、羽毛等
⑤碳酸钠在医疗上是治疗胃酸过多的一种药剂
A.①②③④ B.②③④⑤ C.①②③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
(1)配平以下离子方程式,并在□中填上所需的微粒。
____H++____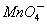 +_____H2C2O4→_____CO2↑+____Mn2++____□
+_____H2C2O4→_____CO2↑+____Mn2++____□
(2)该反应中的还原剂是_______________________。
(3)反应转移了0.4mol电 子,则消耗KMnO4的物质的量为_________mol。
子,则消耗KMnO4的物质的量为_________mol。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是___________________。
②溶解沉淀时_____________(能或不能)用稀盐酸,原因是_____________。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙_______g
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数, 在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则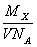 表示的是
表示的是
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲 乙
乙 丙。下列有关物质的推断不正确的是
丙。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是氯气 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式错误的是
A.测得0.1 mol·L-1氨水的pH为11:NH3·H2O NH4+ +OH-
NH4+ +OH-
B.将Na块投入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
D.将1 mol·L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
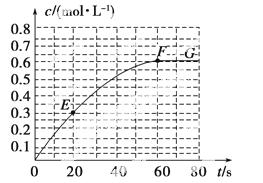
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g)2B(g) ΔH=a  kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为________mol·L-1·s-1。
(2)该反应的平衡常数表达式为________。
(3)若298 K时B的平衡浓度为A的3倍,323 K时( 其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的
其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的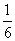 。该反应中ΔH________0(填“>”或“<”)。
。该反应中ΔH________0(填“>”或“<”)。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为________(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是______________________________________________ __________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com