
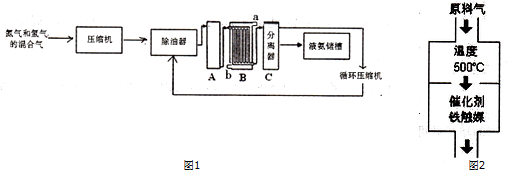
分析 (1)根据图示可知,设备A为合成塔、B为冷凝器或冷凝塔;工业合成氨中合成塔中的反应为氮气和氢气在高温高压条件下生成氨气,据此写出反应的化学方程式;合成氨的反应属于放热反应,根据化学反应速率和平衡移动知识来分析选择500℃的原因;生产中原料气必须进行脱硫,防止催化剂中毒;
(2)B为冷凝器或冷凝塔;作用是利用余热,节约能源;
(3)根据增大压强对平衡移动的影响知识来回答;
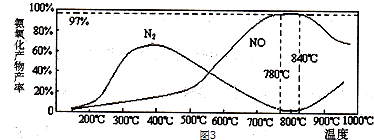
(4)由图象可知,温度高于900℃时,NO的产率降低,氮气的产率增大,各反应为放热反应,高温下不利于向正反应进行,应是NO转变为N2所致;
(5)根据氮原子守恒可知,NH3~NO~HNO3,以此计算.
解答 解:(1)合成氨的工业设备是合成塔;N2与H2合成NH3所用的催化剂是铁砂网,温度过低,反应速率较慢,温度较高,不利合成氨气,选择500℃的主原因是在这个温度下催化剂活性最大;生产中原料气必须进行脱硫可以防止催化剂中毒;
故答案为:合成塔,N2 +3H2 $?_{催化剂}^{高温、高压}$ 2NH3 ,此温度下催化剂效率最高,防止催化剂中毒;
(2)B为冷凝器或冷却塔;合成氨的反应属于放热反应,用热交换器可以充分利用余热,节约能源;氮、氢混合气体送入合成塔前要通过压缩机压缩,来增大压强,这样可以加快化学反应速率,还可以让化学平衡朝生成NH3的方向进行;a和b是两个通水口,其中入水口应考虑下进上出;
故答案为:冷却塔或(冷凝器);利用余热,节约能源;b;
(3)增大压强,加快反应速率,平衡向气体体积减小的方向移动,即平衡朝生成NH3的方向进行;
故答案为:增大压强,加快反应速率,使平衡朝生成NH3的方向进行;
(4)各反应为放热反应,高温下不利于向正反应进行,由图象可知,温度高于900℃时,NO的产率降低,氮气的产率增大,故温度高于900℃时应是部分NO转化为N2;
故答案为:部分NO转化为N2;
(5)由NH3制NO的产率是94%、NO制HNO3的产率是89%,根据氮原子守恒可知,NH3~NO~HNO3,则1mol氨气可得到硝酸1mol×94%×89%=0.8366mol,由HNO3+NH3═NH4NO3,则该反应消耗的氨气的物质的量为0.8366mol,氨气的质量之比等于物质的量之比,则制HNO3所用去的NH3的质量占总耗NH3质量的百分数为 $\frac{1mol}{1mol+0.8366mol}$×100%=54%;即制HNO3所用去的NH3的质量占总耗NH3质量的54%;
故答案为:54.
点评 本题考查了工业制备原理应用,流程分析,实验制备物质的分析判断,利用物质的转化及质量守恒的方法来进行简单计算,使用硝酸铵的注意事项,明确转化中的化学反应得出物质之间的关系是解答的关键,题目难度中等.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:多选题
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:| 物质 数据 | 乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g•cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、X | B. | X、Y、Z | C. | X、Z、Y | D. | Z、Y、X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com