
Li-SO2电池具有输出功率高和低温性能好等特点。其电解质是LiBr,溶剂是碳酸丙烯酯和乙腈,电池反应为2 Li+2SO2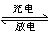 Li2S2O4。下列说法正确的是( )
Li2S2O4。下列说法正确的是( )
A.该电池反应为可逆反应
B.放电时,Li+向负极移动
C.充电时,阴极反应式为Li++e-=Li
D.该电池的电解质溶液可以换成LiBr的水溶液
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:填空题
下图中A、B、C、D、E、F、G均为有机化合物。
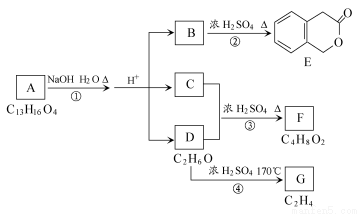
根据上图回答问题:
(1)D的化学名称是________________________。
(2)反应③的化学方程式是________________________________。(有机物须用结构简式表示)
(3)B的分子式是__________________________。
(4)反应①的反应类型是__________________。A的结构简式是_______。
(5)符合下列3个条件的B的同分异构体的数目有____________个。
①含有邻二取代苯环结构;②与B有相同的官能团;③不与FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式________________。
(6)G的重要的工业原料,用化学方程式表示G的一种重要的工业用途________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g) 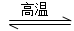 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的质量增加了2.80 g,则H2的平均反应速率为________mol/(L·min);该反应的平衡常数表达式K=________。
(2)上述反应达到平衡后,下列说法正确的是________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4物质的量平衡向左移动
d.其他条件不变,增大HCl物质的量平衡向左移动
(3)一定条件下,在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是________。
a.3v逆(N2)=v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
(4)若平衡时H2和HCl的物质的量之比为m/n,保持其他条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比________m/n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:填空题
温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在前50 s 的平均速率v(PCl3)= 0.0032 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)= 0.11 mol·L-1,则反应的ΔH<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率大于80%
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:填空题
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2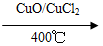 2Cl2+2H2O
2Cl2+2H2O
(1)已知:ⅰ.反应A中,4 molHCl被氧化,放出115.6 kJ的热量。
ⅱ.
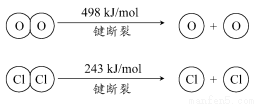
①H2O的电子式是________。
②反应A的热化学方程式是______________________________________。
③断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”)________。
(2)对于反应A,下图是在4种投料比[n(HCl):n(O2),分别为1:1、2:1、4:1、6:1]下,反应温度对HCl平衡转化率影响的曲线。
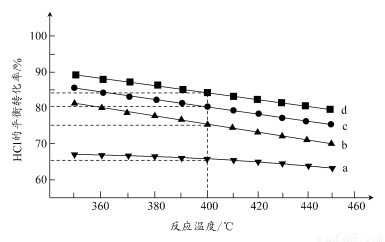
①曲线b对应的投料比是________。
②当曲线b、c、d对应的投料比达到相同的HCl平衡转化率时,对应的反应温度与投料比的关系是______________________________。
③投料比为2:1、温度为400℃时,平衡混合气中Cl2的物质的量分数是________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
下列过程都与热量变化有关,其中表述不正确的是( )
A. CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol
B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题6化学反应与能量变化练习卷(解析版) 题型:选择题
中华商务网讯:2011年中国将超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/(kJ·mol-1) | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.氢键、分子间作用力、离子键、共价键都是微粒间的作用力。其中分子间作用力只影响物质的熔沸点而不影响物质的溶解性。
B.石墨烯是一种从石墨材料中用“撕裂”方法剥离出的单层碳原子面材料,用这种方法从C60、金刚石等中获得“只有一层碳原子厚的碳薄片”也必将成为研究方向。
C.H、S、O三种元素组成的物质的水溶液与Na、S、O三种元素组成的物质的水溶液混合可能会观察到浑浊现象。
D.原子结构模型的演变经历了:
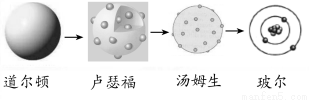
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
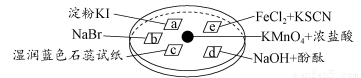
对实验现象的“解释或结论”正确的是( )
选项实验现象解释或结论
Aa处变蓝,b处变红棕色氧化性:Cl2>Br2>I2
Bc处先变红,后褪色氯气与水生成了酸性物质
Cd处立即褪色氯气与水生成了漂白性物质
De处变红色还原性:Fe2+>Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com