
以葡萄糖为燃料的微生物燃料电池结构示意图如下图所示.关于该电池的叙述正确的是( )
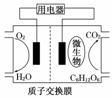 A.该电池能够在高温下工作
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-===6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2
气体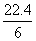 L
L
科目:高中化学 来源: 题型:
关于钠和钾元素的比较中,不正确的是( )
A.钾原子失电子比钠原子容易 B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈 D.KOH碱性比NaOH强
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=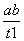 mol·L-1·min-1
mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量Y,平衡后X体积分数与原平衡相比增大
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金 相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。
现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高 温下煅烧,所得物质可作耐高温材料,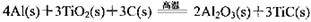
 则反应过程中,每转移1 mol电子放出的热量为________。
则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成 。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
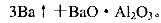 利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
_____________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g) 2NO(g)
2NO(g) 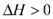
已知该反应在 2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向 2 L 密闭容器中充入 N2 和 O2 各 1 mol,平衡时,N2 的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内 N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_______。
(4)将 N2、O2 的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________。
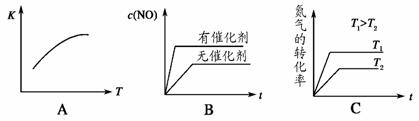
(5)向恒温恒容的密闭容器中充入等物质的量的 N2 和 O2,达到平衡状态后再向其中充入一定量 NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是 ( )
A.当电池负极消耗m g气体时,电解池阳极同时有m g气体生成
B.电池的负极反应式为:O2+2H2O+4e-===4OH-
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电池中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
2008年10月8日,瑞典皇家科学院宣布美籍华裔科学家钱永健获得2008年度诺贝尔化学奖.少年时代,他就对化学产生了浓厚的兴趣.16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项.下列说法正确的是 ( )
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直接电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.由原电池原理知所有的合金都比纯金属更易被腐蚀
D.铜板上的铁铆钉处在潮湿的空气中发生:Fe-3e-===Fe3+,从而形成铁锈,但此过程铜不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是难溶氢氧化物在不同pH下的溶解度(S,mol/L),下列说法中正确的是( )
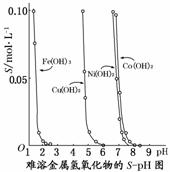
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:X(g)+Y(g)⇌2Z(g),已知X、Y、Z的起始浓度分别为0.1mol/L、0.2mol/L、0.2mol/L,在一定条件下,达到平衡时,各物质的浓度不可能是( )
|
| A. | Z为0.3 mol/L | B. | Y为0.15 mol/L |
|
| C. | X为0.1 mol/L | D. | Z为0.4 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com