
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
分析 (1)①根据氨气的物质的量计算出消耗的氮气的物质的量,再根据v=$\frac{△c}{△t}$计算出0~1min内N2的平均反应速度率;
②根据3、4min的时间段氨气的物质的量不变,说明达到了平衡状态,根据氨气的物质的量计算出消耗的氮气和氢气的物质的量及平衡时的浓度,
再根据平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$计算出该温度下的平衡常数;
③根据加入N2、H2和氨气后的浓度商判断平衡移动方向;平衡常数是温度的函数,温度不变,平衡常数不变;
④达到平衡状态时是正逆反应速率相等,各组分的浓度保持不变的状态;
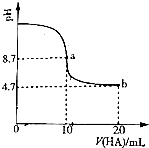
(2)A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性;
B.b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离;
C.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度;
D.pH=7时,c(H+)=c(OH-),结合电荷守恒判断;
E.根据物料守恒分析解答.
解答 解:(1)①0~1min内生成了0.2mol氨气,根据反应N2(g)+3H2(g)?2NH3(g),消耗了氮气的物质的量为:n(N2)=$\frac{1}{2}$n(NH3)=0.1mol,0~1min内N2的平均反应速度率为:v(N2)=$\frac{\frac{0.1mol}{2.00L}}{1min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
②根据表中数据可知,反应在第3和4分钟时间段内氨气的物质的量不变,说明达到了平衡状态,此时生成了1.00mol氨气,
列出化学平衡的三段式为 N2(g)+3H2(g)?2NH3(g),
反应开始前(mol) 1.5 4.5 0
变化量(mol) 0.5 1.5 1
平衡时(mol) 1 3 1
平衡时浓度(mol/L) 0.500 1.500 0.5
此温度下该反应的化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{0.50{0}^{2}}{1.50{0}^{3}×0.500}$≈0.15,
故答案为:0.15;
③反应达到平衡后,若往平衡体系中再加入N2、H2O、NH3各1mol,此时各组分的浓度为:
c(N2)=$\frac{1.00mol+1.00mol}{2.00L}$=1.00mol/L,c(H2)=$\frac{3.00mol+1.00mol}{2.00L}$=2.00mol/L,c(N2)=$\frac{1.00mol+1.00mol}{2.00L}$=1.00mol/L,
浓度商为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{1.0{0}^{2}}{2.0{0}^{3}×1.00}$=0.125<k=0.15,所以平衡向着正向移动,平衡常数是温度的函数,温度不变,平衡常数不变,
故答案为:正向;不变;
④A.只要反应发生就符合,N2的转化率等于NH3的产率,故A错误;
B.混合气体的平均相对分子质量不变,说明气体的物质的量不变,反应达平衡状态,故B正确;
C.只要反应发生,v(N2)与v(H2)的比值一直不变,故C错误;
D.体积不变,气体的质量不变,混合气体的密度一直不变,故D错误;
故选B;
(2)A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,应为c(HA)>c(H+),故A错误;
B.a点A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,故B错误;
C.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(HA),故C正确
D.pH=7时,c(H+)=c(OH-),由电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故D错误;.
E.根据物料守恒b点所示溶液中c(HA)+c(A-)=$\frac{0.3×20}{10+20}$=0.2mol/L,故E正确;
故选CE.
点评 本题考查了化学平衡常数的计算与应用、化学反应速率与化学计量数的关系、酸碱混合的定性判断等知识,涉及的知识点较多,试题综合性强,难度较大,有利于培养学生的逻辑思维能力和发散思维能力,提高学生的应试能力和学习效率.


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐水中的泥沙 | |
| B. | 用蒸馏的方法将自来水制成蒸馏水 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 用分液的方法分离食盐水和汽油的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3和CH3CH(CH3)2属于碳链异构 | |
| B. | 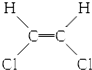 和 和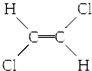 属于位置异构 属于位置异构 | |
| C. | CH2═C(CH3)2和CH3CH═CHCH3属于官能团异构 | |
| D. | CH3CH2CH2COOH和CH3COOCH2CH3属于位置异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CCl4提取碘水中的碘 | |
| B. | 用水去除硬脂酸钠中的甘油 | |
| C. | 用NaOH溶液除去溴苯中的溴 | |
| D. | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
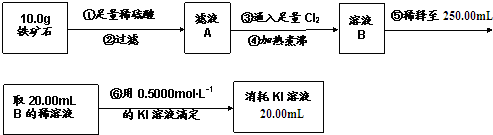
| A. | 步骤④中煮沸的作用是为了除去残留的氯气 | |
| B. | 步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 | |
| C. | 铁矿石中铁的百分含量为56% | |
| D. | 该铁矿石中若含氧为24%,则铁的氧化物的化学式为Fe2O3•3FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的浓度变为0.08mol/L | B. | 阳极上产生112ml O2 (标准状况) | ||
| C. | 转移的电子数是1.204×1022 个 | D. | 反应中有0.01mol Ag 被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A | NaClO | 离子键、共价键 | 强氧化性 | 消毒液 |
| B | H2O2 |  | 不稳定,易分解 | 医用消毒剂 |
| C | NH3 | 共价键 | 水溶液呈弱碱性 | 工业制硝酸 |
| D | NaHCO3 | 离子键 | 受热易分解 | 泡沫灭火器 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com