
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。根据以上所给的数据计算反应:
2H2(g)+O2(g)=2H2O(g) ;△H = 。
(2)如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
①酸式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
②碱式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
(1)-484kJ/mol
(2)①2H2-4e-=4H+ O2+4e-+4H+=2H2O 2H2+O2=2H2O 变大
②2H2-4e-+4OH-=4H2O O2+4e-+2H2O=4OH- 2H2+O2=2H2O 变小
解析试题分析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据键能可知,该反应的反应热△H=436kJ/mol×2+496kJ/mol-2×2×463kJ/mol=-484kJ/mol。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此在氢氧燃料电池中,氢气在负极通入,失去电子。氧气在正极通入,得到电子。
①如果是酸式电池,则电极反应是负极2H2-4e-=4H+,正极O2+4e-+4H+=2H2O;电池总反应:2H2+O2=2H2O;反应中有水生成,氢离子的浓度降低,所以电解质溶液pH变大。
①如果是碱式电池,则电极反应是负极2H2-4e-+4OH-=4H2O,正极O2+4e-+2H2O=4OH-;电池总反应:2H2+O2=2H2O;反应中有水生成,OH-的浓度降低,所以电解质溶液pH变小。
考点:考查反应热的计算、氢氧燃料电池中电极反应式的书写等
点评:该题是高考中的常见题型,属于中等难度的试题。试题在注重对学生基础知识巩固和训练的同时,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的灵活应变能力和规范答题能力。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
氯碱工业中电解饱和食盐水的原理示意图如下图所示:
(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池): 
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为 腐蚀和 腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是 (填序号)。
(3)②中正极的电极反应式为 ,
负极的电极反应式为 ,
③中负极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是:
(2)石墨电极(C)的电极反应式为
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_ L;丙装置中阴极析出铜的质量为 g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_ 极,电解质溶液最好用_ 。若用于制 Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用 作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)如下图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为: ___ ;
②电解质溶液为NaOH溶液时,灯泡__________(填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Al电极上发生反应的电极反应式为:_______________ ;
b.若灯泡不亮,其理由为:________________________ 。
(2)原电池原理的应用之一是可以设计原电池。请利用反应“Cu+2Fe3+ =2Fe2+ +Cu2+ ”设制一个原电池(正极材料用碳棒)则该电池的负极材料是 ,正极上发生反应的电极反应式 ;若导线上转移电子1.5 mol,则溶解铜的质量是 。另外的重要应用是实验室在用锌与稀硫酸反应制备氢气时,可向溶液中滴加少量硫酸铜溶液,其作用是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。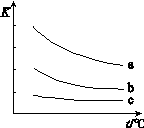
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(8分)请用相关知识回答下列问题:
(1)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程测得的CO2气体体积随时间变化如右图所示。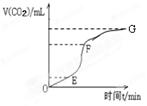
①________段化学反应速率最快,_______段收集的二氧化碳气体最多。
②除加入蒸馏水外,当加入下列物质中的 (填序号)时,则能够减缓上述反应的速率。
A.醋酸钠溶液 B.碳酸钙粉末 C.稀硫酸 D.浓盐酸
(2)原电池是一种能量装置。
①下列在理论上可用来设计原电池的反应是 (填序号)。
A.NaOH +HCl==NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
C.CuSO4 +2NaOH== Cu(OH)2+NaSO4 D.C2H6O +3O2==3H2O+2CO2
②实验室中用锌片与硫酸反应制取氢气时,向反应溶液中滴加几滴CuSO4溶液,可以发现产生氢气速率明显加快,其原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com