
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
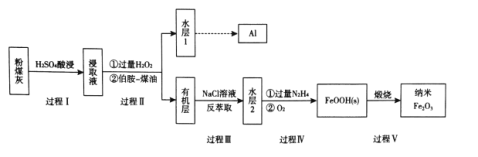
已知:i伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。
ii Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-
[FeCl6]3-
(1)写出过程I中Fe2O3发生反应的离子方程式:____。
(2)过程II加入过量H2O2的作用是 ___ 。
(3)过程II加入伯胺一煤油对浸取液进行分离,该操作的名称是_____。
(4)从化学平衡角度解释过程III利用NaCI溶液进行反萃取的原理:_____。
(5) N2H4具有碱性,可与H+结合生成N2H5+。过程IV中先用过量的N2H4将水层2中Fe3+转化为Fe2+并生成N2,反应的离子方程式为____,得到的Fe2+再被O2氧化为FeOOH。
(6)纳米Fe2O3在常压电化学法合成氨过程中起催化作用。该电解装置如图所示。
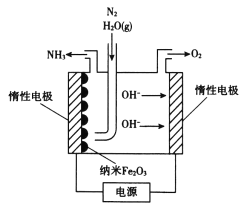
已知熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe。用化学用语表示Fe2O3在阴极催化生成NH3的反应过程。
第一步:____,
第二步:____。
【答案】Fe2O3+6H+=2Fe3++3H2O 将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率 萃取、分液 Fe3++6Cl-![]() [FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取 4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl- Fe2O3+3H2O+6e-=2Fe+6OH- 2Fe+N2+3H2O= Fe2O3+2NH3
Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取 4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl- Fe2O3+3H2O+6e-=2Fe+6OH- 2Fe+N2+3H2O= Fe2O3+2NH3
【解析】
粉煤灰主要成分有A12O3、Fe2O3、Fe3O4和SiO2等物质,加入硫酸酸浸,A12O3、Fe2O3、Fe3O4溶于硫酸生成硫酸铝、硫酸铁和硫酸亚铁,SiO2不溶,分离后,浸取液含有Al3+、Fe3+、Fe2+和SO42-等,在浸取液中先加入过量的H2O2将Fe2+全部氧化为Fe3+,再加入伯胺-煤油进行萃取,经分液得到水层和有机层,水层中含有Al3+,经后期处理得到金属铝。有机层为含有Fe(NH2-R)(OH)SO4的煤油层,向有机层中加入NaCl溶液经反萃取得到的水层中含有[FeCl6]3-,向水层2中加入N2H4将Fe3+还原为Fe2+,Fe2+再经氧化转化为FeOOH,煅烧FeOOH得到纳米Fe2O3,据此解答。
(1)根据以上分析,过程I中Fe2O3和硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)由信息可知,伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。所以过程II加入过量H2O2的作用是将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率,
Fe(NH2-R)(OH)SO4+H+生成易溶于煤油的产物。所以过程II加入过量H2O2的作用是将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率,
故答案为:将Fe2+完全氧化为Fe3+,有利于与伯胺反应,提高萃取率;
(3) 过程II加入伯胺-煤油进行萃取,经分液得到水层和有机层,该分离操作为萃取、分液,
故答案为:萃取、分液;
(4) 有机层存在平衡:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+,过程III加入NaCl溶液发生:Fe3++6Cl-
Fe(NH2-R)(OH)SO4+H+,过程III加入NaCl溶液发生:Fe3++6Cl-![]() [FeCl6]3-反应,使Fe3+浓度下降,平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取,
[FeCl6]3-反应,使Fe3+浓度下降,平衡向逆反应方向移动,Fe3+从易溶于煤油的物质中转移到易溶于水的物质中,实现反萃取,
故答案为:Fe3++6Cl-![]() [FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O
[FeCl6]3-(已知ii中的反应)使Fe3+浓度下降,3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶煤油的物质中转移到易溶于水的物质中,实现反萃取;
Fe(NH2-R)(OH)SO4+H+(已知i中的反应)平衡向逆反应方向移动,Fe3+从易溶煤油的物质中转移到易溶于水的物质中,实现反萃取;
(5)过量的N2H4将Fe3+转化为Fe2+并生成N2,根据得失电子守恒和电荷守恒及原子守恒,反应的离子方程式为4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,
故答案为:4Fe3++5N2H4=4Fe2++N2+4N2H5+或4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-;
(6)由图可知,该电解装置中,阴阳极均为惰性电极,熔融NaOH-KOH为电解液,Fe2O3在阴极发生电极反应生成中间体Fe,Fe与N2、水反应生成NH3和Fe2O3,Fe2O3在该过程中起催化作用,故反应分两步,第一步:Fe2O3+3H2O+6e-=2Fe+6OH-,第二步:2Fe+N2+3H2O= Fe2O3+2NH3,
故答案为:Fe2O3+3H2O+6e-=2Fe+6OH-;2Fe+N2+3H2O= Fe2O3+2NH3。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法错误的是
A. 3g 3He含有的中子数为1NA
B. 1 L 0.1 mol·L1磷酸钠溶液含有的![]() 数目为0.1NA
数目为0.1NA
C. 1 mol K2Cr2O7被还原为Cr3+转移的电子数为6NA
D. 48 g正丁烷和10 g异丁烷的混合物中共价键数目为13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)主要用于冶炼金属铬、有机化学合成的催化剂等.工业上是以铬铁矿[主要成份为Fe(CrO2)2,还含有Al2O3、SiO2等杂质]为主要原料进行生产,其主要工艺流程如下:

(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)焙烧时的主要反应为:4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
8Na2CrO4+2Fe2O3+8CO2,其中被氧化的元素为___,每产生32g Fe2O3,转移电子的物质的量为_______,该步骤不能使用陶瓷容器,原因是_______。
(3)操作I包括过滤与洗涤,简述实验室中洗涤沉淀的操作:__________。
(4)硫磺在与铬酸钠的反应中转化为硫代硫酸钠,反应的离子方程式为___________,滤渣中除Al(OH)3外还有_______(填化学式)。
(5)某工厂用448 kg铬铁矿粉[含Fe(CrO2)280%]制备Cr2O3,最终得到产品182.4 kg,产率为______。
(6)Cr3+也有一定毒性,会污染水体,常温下要除去废液中多余的Cr3+,调节pH至少为_______,才能使铬离子沉淀完全 (已知:离子浓度小于1×10-5mol/L时沉淀就达完全, Cr(OH)3的Ksp=1.0×10-32)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.4 mol某气体的体积为9.8 L,则该气体的摩尔体积为____________。
(2)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_________________(填序号)。
(3)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为__________
(4)实验室用Na2CO3·10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3·10H2O的质量是___________。
(5)某学生欲用12mol·L-1浓盐酸和蒸馏水配制500 mL 0.3 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是__________(填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的干馏实验装置如图所示。下列说法错误的是( )

A.c口导出的气体可使新制氯水褪色B.从b层液体中分离出苯的操作是分馏
C.长导管的作用是导气和冷凝D.可用蓝色石蕊试纸检验a层液体中含有的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 。下列关于该有机物分子结构的说法中正确的是
。下列关于该有机物分子结构的说法中正确的是
A. 最多有18个原子在同一平面内 B. 最多有4个碳原子在一条直线上
C. 最多有12个碳原子在同一平面内 D. 所有原子都可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如右图所示。据图分析,下列判断错误的是

A. Ksp[Fe(OH)3]< Ksp [Cu(OH)2]
B. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下列材料,按要求回答问题:酒精、苯(密度小于水,且不溶于水)、CCl4都是有机溶剂,液溴Br2和碘(I2)皆难溶于水,都易溶于上述有机溶剂。
(1)在酒精、苯、NaCl溶液3种试剂中:能把溴单质从溴水中萃取出来的是________,萃取时上层液体呈________色,下层液体呈________色。
(2)乙醇和乙酸可以互溶,若要分离两者,可通过蒸馏实现,请指出图中实验装置中的错误之处:①________________;②______________;③________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com