
不饱和酯类化合物在药物、涂料等领域应用广泛。
(1)下列关于化合物Ⅰ的说法,正确的是________。
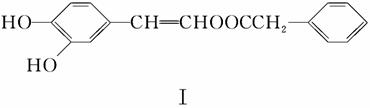
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1 mol化合物Ⅰ最多能与2 mol NaOH反应
(2)反应①是一种由烯烃直接制备不饱和酯的新方法:
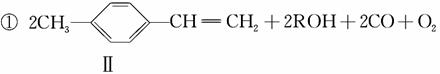

化合物Ⅱ的分子式为________,1mol化合物Ⅱ能与________mol H2恰好完全反应生成饱和烃类化合物。
(3)化合物Ⅱ可由芳香族化合物Ⅲ或Ⅳ分别通过消去反应获得,但只有Ⅲ能与Na反应产生H2,Ⅲ的结构简式为________(写1种);由Ⅳ生成Ⅱ的反应条件为________。
(4)聚合物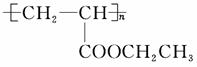 可用于制备涂料,其单体结构简式为 ________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为_________________________________________________
可用于制备涂料,其单体结构简式为 ________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为_________________________________________________
_____________________________________________________。
解析 (1)A项,化合物Ⅰ分子中含酚羟基,遇FeCl3溶液可显紫色,正确;B项,分子中不含醛基,不能发生银镜反应,含有酚羟基,可以发生酯化反应,错误;C项,分子中苯环上羟基邻对位的H可与溴发生取代反应,分子中碳碳双键可与溴发生加成反应,正确;D项,分子中含2个酚羟基和1个酯基,所以1 mol化合物Ⅰ最多能与3 mol NaOH反应,错误。(2)根据化合物Ⅱ的结构简式可知其分子式为C9H10,化合物Ⅱ分子中含1个苯环和1个双键,故1 mol化合物Ⅱ分子能与4 mol H2恰好反应生成饱和烃类化合物。(3)化合物Ⅲ能与Na反应产生H2且通过消去反应制得化合物Ⅱ,说明化合物Ⅲ分子含羟基,并且羟基在形成双键的碳原子上,Ⅲ的结构简式为: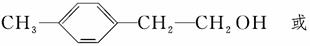
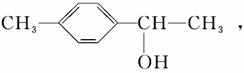 化合物Ⅳ不能与Na反应产生H2,但可发生消去反应制得化合物Ⅱ,说明化合物Ⅳ为卤代烃,卤代烃发生消去反应的条件为NaOH醇溶液,加热。(4)由聚合物的结构简式可知其单体为CH2==CHCOOCH2CH3,以乙烯为原料,先制取乙醇,再按照反应①原理制取丙烯酸乙酯,其化学方程式为:CH2==CH2+H2O
化合物Ⅳ不能与Na反应产生H2,但可发生消去反应制得化合物Ⅱ,说明化合物Ⅳ为卤代烃,卤代烃发生消去反应的条件为NaOH醇溶液,加热。(4)由聚合物的结构简式可知其单体为CH2==CHCOOCH2CH3,以乙烯为原料,先制取乙醇,再按照反应①原理制取丙烯酸乙酯,其化学方程式为:CH2==CH2+H2O CH3CH2OH,2CH2==CH2+2CO+O2+2CH3CH2OH
CH3CH2OH,2CH2==CH2+2CO+O2+2CH3CH2OH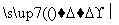 2CH2==CHCOOCH2CH3+2H2O。
2CH2==CHCOOCH2CH3+2H2O。
答案 (1)AC (2)C9H10 4
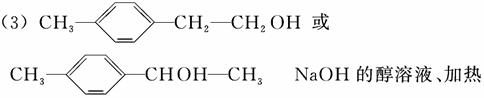
(4)CH2==CH—COOCH2CH3
CH2==CH2+H2O CH3CH2OH,
CH3CH2OH,
2CH2==CH2+2CH3CH2OH+2CO+O2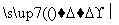
2CH2==CHCOOCH2CH3+2H2O


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T的原子最外层共有________种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是_______。
(2)元素Y与氢元素形成一种离子YH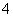 ,写出该微粒的电子式 ________(用元素符号表示)。
,写出该微粒的电子式 ________(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种酸的是________,理由是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列给出14种元素的电负性:
| 元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
请运用元素周期律知识完成下列各题。
(1)同一周期中,从左到右,元素的电负性逐渐________;同一主族中,从上到下,元素的电负性逐渐________。所以,元素的电负性随原子序数的递增呈________变化。
(2)短周期元素中,由电负性最大的元素与电负性最小的元素形成的化合物的化学式为________,用电子式表示该化合物的形成过程:____________________________________。
(3)表中符合“对角线规则”的元素有Li和________、Be和________、B和________,它们的性质分别有一定的相似性,其原因是____________________,写出Be(OH)2与强酸及强碱反应的离子方程式:____________________________________。
(4)一般认为,两成键元素间电负性差值大于1.7时形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。判断Mg3N2、SO2、AlCl3、CS2、MgO是离子化合物还是共价化合物。
离子化合物___________________________________________
共价化合物___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
从石油分馏得到的固体石蜡,用氯气漂白后燃烧时会产生含氯元素的气体,这是由于漂白时发生过( )
A.加成反应 B.取代反应
C.裂解反应 D.催化裂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
CO2气体在一定条件下可与金属镁反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用力分别是( )
A.化学键,化学键
B.化学键,分子间作用力
C.分子间作用力,化学键
D.分子间作用力,分子间作用力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com