
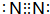 ����д��������Ԫ����ɵķ����к���4��ԭ�Ӻ���Ϊ18���ӽṹ�����ʵĻ�ѧʽH2O2
����д��������Ԫ����ɵķ����к���4��ԭ�Ӻ���Ϊ18���ӽṹ�����ʵĻ�ѧʽH2O2���� A��B��C��D��E��FΪ������ԭ��������������Ķ�����Ԫ�أ�B��C��D��E��F�ļ����ӵĵ��Ӳ�ṹ��ͬ��Ϊ10��������A��Eͬ���壬��Eֻ�ܴ��ڵ������ڣ���BΪNԪ�ء�CΪOԪ�ء�DΪFԪ�أ�ԭ�ӵ������������Ĺ�ϵΪA+D=B+F=8����Aԭ������������Ϊ1��Fԭ������������Ϊ3����A��E����IA�壬��EΪNa��F���ڢ�A�壬��FΪAl����ϣ�4��A�����γ�A2���壬AΪHԪ�أ��ݴ˽��
��� �⣺A��B��C��D��E��FΪ������ԭ��������������Ķ�����Ԫ�أ�B��C��D��E��F�ļ����ӵĵ��Ӳ�ṹ��ͬ��Ϊ10��������A��Eͬ���壬��Eֻ�ܴ��ڵ������ڣ���BΪNԪ�ء�CΪOԪ�ء�DΪFԪ�أ�ԭ�ӵ������������Ĺ�ϵΪA+D=B+F=8����Aԭ������������Ϊ1��Fԭ������������Ϊ3����A��E����IA�壬��EΪNa��F���ڢ�A�壬��FΪAl����ϣ�4��A�����γ�A2���壬AΪHԪ�أ�
��1��N2���ʵĵ���ʽ��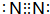 ��������Ԫ����ɵķ����к���4��ԭ�Ӻ���Ϊ18���ӽṹ�����ʵĻ�ѧʽΪH2O2���ʴ�Ϊ��
��������Ԫ����ɵķ����к���4��ԭ�Ӻ���Ϊ18���ӽṹ�����ʵĻ�ѧʽΪH2O2���ʴ�Ϊ��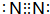 ��H2O2��
��H2O2��
��2��E������������Ӧˮ����ΪNaOH������Al3+���ӵ���Һ�еμӹ���NaOH����Һ�������ӷ���ʽ�ǣ�Al3++3OH-�TAl��OH��3����Al��OH��3+OH-�TAlO2-+2H2O��
�ʴ�Ϊ��Al3++3OH-�TAl��OH��3����Al��OH��3+OH-�TAlO2-+2H2O��
��3��N2H4ͨ�����ȵ�����ͭ��ĩ����ĩ�ɺ�ɫ��Ϊ��ɫ���Ҳ���Դ�������Ⱦ����Ӧ����Cu��������ˮ����ѧ��Ӧ����ʽ�ǣ�N2H4+2CuO$\frac{\underline{\;\;��\;\;}}{\;}$2Cu+N2+2H2O��
�ʴ�Ϊ��N2H4+2CuO$\frac{\underline{\;\;��\;\;}}{\;}$2Cu+N2+2H2O��
��4����2L���ܱ������У�ͨ��2mol N2�����3mol H2���壬һ���¶��·�Ӧ����NH3���壬����Ӧ�ﵽƽ��ʱ��H2��Ũ��Ϊ0.15mol•L-1��ͬʱ�ų�Լ83.2kJ����������μӷ�Ӧ����Ϊ3mol-0.15mol/L��2L=2.7mol����3mol������Ӧ�ų�������Ϊ83.2kJ��$\frac{3mol}{2.7mol}$=92.4kJ���÷�Ӧ���Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��=2NH3��g����H=-92.4 kJ•mol-1��
�ʴ�Ϊ��N2��g��+3H2��g��=2NH3��g����H=-92.4 kJ•mol-1��
��5��������NaN3��ˮ���Է�Ӧ�����������嵥�ʺ�һ�ּӦ���ɵ������������������ƣ��仯ѧ����ʽΪ��2NaN3+2H2O�T3N2��+H2��+2NaOH����0.1mol��NaN3��ȫ��Ӧ��NԪ��ƽ�����ϼ���-$\frac{1}{3}$����Ϊ0�ۣ���ת�Ƶ��ӵ����ʵ���Ϊ0.1mol��3��$\frac{1}{3}$=0.1mol��
�ʴ�Ϊ��2NaN3+2H2O�T3N2��+H2��+2NaOH��0.1mol��
���� ���⿼��Ԫ���ƶϡ����û�ѧ������д������ת�Ƽ���ȣ�ע�����ճ���10�������ӣ��Ƕ�ѧ���ۺ������Ŀ��飬�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
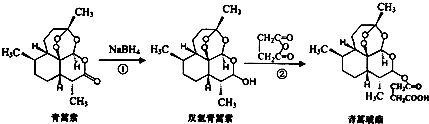
| A�� | �����ط���ʽΪC15H22O5 | |
| B�� | �����ز�����NaOH��Һ��Ӧ | |
| C�� | ��Ӧ��ԭ��������Ϊ100% | |
| D�� | ����������������������Һ��Ӧ���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NO2-���������� Na2O2-���������� Al2O3-���������� | |
| B�� | ����-����� ����-������ ���ʯ-���� | |
| C�� | ����-�� ����-�� С�մ�-��ʽ�� | |
| D�� | Һ��-�ǵ���� ���ᱵ-ǿ����� ����-������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������������ʷֱ������������ַ�Ӧʱ��NaHCO3����CO2����� | |
| B�� | �����ó���ʯ��ˮ��������������Һ���� | |
| C�� | �������������ʷֱ��������ĵ�Ũ�����ᷴӦʱ��һ����Na2CO3����CO2����� | |
| D�� | NaHCO3��Na2CO3�������ʿ����ü��ȷ�����ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1L0.5mol•L-1��ˮ������NH4+��Ϊ0.5NA | |
| B�� | 1molFe������������Ӧת�Ƶĵ�����Ϊ2NA | |
| C�� | ��״���£�33.6LCO2Լ����1.5NA������ | |
| D�� | 1mol 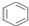 �к�̼̼˫����Ϊ3NA �к�̼̼˫����Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
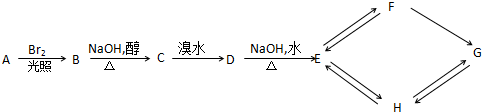
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��Դ�ǵ�����ᷢչ������֧��֮һ����ר��ָ���������ȼ�ϲ�����CO2��H2O��N2���ܹ�ʵ������̫����������������ϣ���ͼ�������Խ�Լȼ�ϣ�������ԴΣ�����ڴ˹��������ѭ����̫��������ת����������
��Դ�ǵ�����ᷢչ������֧��֮һ����ר��ָ���������ȼ�ϲ�����CO2��H2O��N2���ܹ�ʵ������̫����������������ϣ���ͼ�������Խ�Լȼ�ϣ�������ԴΣ�����ڴ˹��������ѭ����̫��������ת����������| A�� | ��ѧ�� | B�� | ���� | C�� | ������ | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com