
分析 (1)①根据总反应的特点判断氯化铝的作用;
②Al4C3中C元素化合价为-4价,Al4C3与盐酸反应生成甲烷;
(2)①镁、铝是亲氧元素,易被氧气氧化;
②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气;
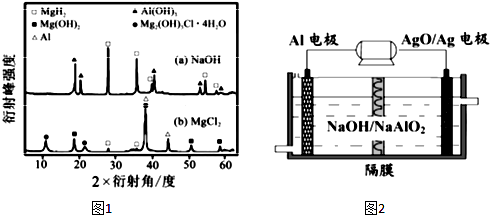
③由图象可知,在氢氧化钠溶液中,充分反应后,固体中存在大量的MgH2,说明Mg在碱性条件下不反应,反应后铝的含量较小,且生成大量的氢氧化铝;
(3)该原电池中,铝易失去电子作负极,则银是正极,负极上铝和氢氧化钠反应生成偏铝酸钠,正极上氧化银得电子生成银,据此写出电池反应式.
解答 解:(1)①由反应可知氯化铝和碳在氯化铝催化作用下生成铝和CO,氯化铝起到催化剂的作用,故答案为:催化剂;
②Al4C3中C元素化合价为-4价,Al4C3与盐酸反应生成甲烷,反应的方程式为Al4C3+12HCl=4AlCl3+3CH4↑,故答案为:Al4C3+12HCl=4AlCl3+3CH4↑;
(2)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,故答案为:防止Mg Al被空气氧化;
②1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol;
③由图象可知,在氢氧化钠溶液中,充分反应后,固体中存在大量的MgH2,说明Mg在碱性条件下不反应,反应后铝的含量较小,且生成大量的氢氧化铝,说明铝在碱性条件下生成氢氧化铝和氢气,反应的离子方程式为2Al+6H2O=2Al(OH)3+3H2↑,故答案为:Al;2Al+6H2O=2Al(OH)3+3H2↑;
(3)铝做负极,失电子被氧化,在碱性溶液中生成NaAlO2,氧化银做正极,得电子被还原为Ag,电解质溶液为NaOH溶液,所以其电池反应式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,故答案为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O.
点评 本题以铝为题材,综合考查物质的性质与制备,为高考常见题型,侧重考查盖斯定律、铝及其化合物的性质以及电化学反应方程式,意在考查考生阅读新信息,处理新情况的能力,电极反应式的书写是易错点,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当闭合开关S1,断开开关S2,右石墨棒发生的电极反应为:2H2O-4e-=4H++O2↑ | |
| B. | 石墨棒使用前在高温火焰上灼烧至红热,迅速浸入冷水,可以使表面粗糙多空,吸附更多的气体 | |
| C. | 先闭合开关S1,一段时间后断开,再闭合S2,可以观察到发光二级管发光 | |
| D. | 断开S2,闭合S1,更换电解质,可以用来模拟工业制氯气,粗铜冶炼制精铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热使c(H+)增大 | B. | 投入一小块金属钠 | ||
| C. | 加入少量NH4Cl固体 | D. | 以铁为电极进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋和牛奶都含有大量蛋白质,可以在微波炉中加热牛奶和完整的鸡蛋 | |
| B. | 炒菜时油锅着火可以迅速盖上锅盖 | |
| C. | 天然气、沼气主要成分是甲烷,液化石油气的主要成分是丙烷、丁烷等 | |
| D. | 桌台抹布上有很多油污,放进沸水中并加少量纯碱煮几分钟会变得很干净 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于NA至2NA之间 | |
| B. | 0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为22.4 L | |
| C. | 0.2 mol•L-1 Na2S溶液中含有的S2-数目小于0.2NA | |
| D. | 在反应Zn+2HNO3+NH4NO3═N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>M>X>Y>Z | B. | 原子半径:Z>W>M>Y>X | ||
| C. | 离子半径:W2+>Z+>M->Y2- | D. | 最简单氢化物的热稳定性:M>Y>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com