
| A. | 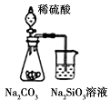 此装置可证明非金属性强弱:S>C>Si | |
| B. | 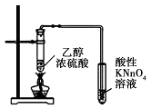 此装置可用于检验有乙烯生成 | |
| C. | 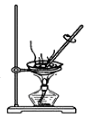 此装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 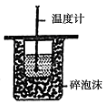 此装置可用来测定中和热 |
分析 A.发生强酸制取弱酸的反应;
B.乙醇易挥发,乙醇、乙烯均使高锰酸钾褪色;
C.加热促进水解,生成的盐酸易挥发;
D.图中缺少环形玻璃搅拌棒.
解答 解:A.发生强酸制取弱酸的反应,可知酸性为硫酸>碳酸>硅酸,则非金属性S>C>Si,故A正确;
B.乙醇易挥发,乙醇、乙烯均使高锰酸钾褪色,不能检验乙烯的生成,故B错误;
C.加热促进水解,生成的盐酸易挥发,则蒸干不能制备,故C错误;
D.图中缺少环形玻璃搅拌棒,不能准确测定最高温度,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握实验装置的作用、酸性比较、物质检验、盐类水解、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液 | NaNO3溶液为无色,Na2SiO3溶液变成红色 | 非金属性:N>Si |
| B | 将湿润的KI-淀粉试纸置于集满某气体的集气瓶口 | 试纸变蓝 | 该气体为Cl2 |
| C | 将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体 | CuSO4颜色未发生改变 | 收集到纯净的SO2 |
| D | 向含有少量FeCl3的FeCl2溶液中加入铜粉 | 铜粉有剩余 | 所得溶液中的溶质只有FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

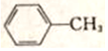 ,G的名称是苯甲醛.
,G的名称是苯甲醛.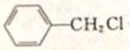 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$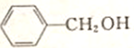 +NaCl.
+NaCl. .
. 以物质的量之比2:1反应得到化合物的结构简式为
以物质的量之比2:1反应得到化合物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的汽油和甲烷燃烧,甲烷产生的热量比汽油多,因此甲烷更高效 | |
| B. | 产生相同热量所生成的二氧化碳,汽油比甲烷多,因此甲烷更低效 | |
| C. | 甲烷含碳量低,燃烧更充分,不易积炭,不易产生CO,因此更环保 | |
| D. | 等物质的量的汽油和甲烷燃烧,汽油产生的热量比甲烷多,因此更环保 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
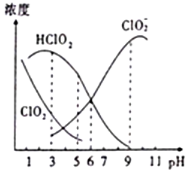 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )| A. | 25℃时,ClO2-的水解平衡常数Ka=10-6 | |
| B. | 在pH约为4.0~4.5范围内使用该漂白剂较好 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+c(H+)+c(Na+)═c(ClO2-)+2c(OH-) | |
| D. | 当pH=5时往NaClO2溶液中滴入稀氢氧化钠溶液,溶液中主要反应的离子方程式是:HClO2+OH-═H2O+ClO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2SO4与pH=12的NaOH等体积混合,所得溶液呈酸性 | |
| B. | 0.1mol/L的CH3COOH溶液在加水稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$减小 | |
| C. | pH=5的NaHSO4溶液中水的电离程度小于纯水的电离程度 | |
| D. | 0.1mol/L的NaHCO3溶液中:c(OH-)═(H+)+2c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
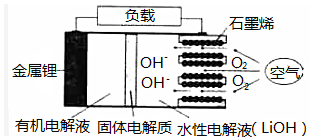 新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )
新型锂一空气电池具有能量密度高的优点,有望成为新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过.下列说法正确的是( )| A. | 放电时,负极反应式:Li-e-+OH-═LiOH | |
| B. | 放电时,当外电路中有1mole-转移时,水性电解液离子总数增加NA | |
| C. | 应用该电池电镀铜,阴极质量增加64g,理沦上将消耗11.2LO2 | |
| D. | 若把水性电解液换成固体氧化物电解质,则易引起正极材料碳孔堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液显酸性 | |
| B. | 加热蒸馏水,Kw变大,pH变小 | |
| C. | 常温下,0.01mol•L-1的Ba(OH)2溶液pH为12 | |
| D. | 醋酸溶液加水稀释,所有离子的浓度都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com