
���� ��A�м�����NaOH��Һ�����ˡ�ϴ�ӡ����յõ�����ɫ����28gΪFe2O3������к���FeԪ�أ�����ú���ɫ�������Ԫ����ͬ���������OԪ�أ�ÿһ����FeԪ������Ϊ28g��$\frac{112}{160}$=19.6g�������ʵ���Ϊ$\frac{19.6g}{56g/mol}$=0.35mol��
��B�м�8.0gͭ�۳�ַ�Ӧ���ˡ�ϴ�ӡ����¸���ù���1.6g����2Fe3++Cu=2Fe2++Cu2+���μӷ�ӦCu������Ϊ8.0g-1.6g=6.4g�������ʵ���Ϊ0.1mol���ɷ���ʽ��֪Fe3+Ϊ0.2mol���ʻ�����Fe2+Ϊ0.35mol-0.2mol=0.15mol����FeO•��Fe2O3���ʵ���֮��Ϊ0.15mol��0.1mol=3��2����Ļ�ѧʽΪ3FeO•2Fe2O3������Fe7O9����
��� �⣺��A�м�����NaOH��Һ�����ˡ�ϴ�ӡ����յõ�����ɫ����28gΪFe2O3������к���FeԪ�أ�����ú���ɫ�������Ԫ����ͬ���������OԪ�أ�ÿһ����FeԪ������Ϊ28g��$\frac{112}{160}$=19.6g�������ʵ���Ϊ$\frac{19.6g}{56g/mol}$=0.35mol��
��B�м�8.0gͭ�۳�ַ�Ӧ���ˡ�ϴ�ӡ����¸���ù���1.6g����2Fe3++Cu=2Fe2++Cu2+���μӷ�ӦCu������Ϊ8.0g-1.6g=6.4g�������ʵ���Ϊ0.1mol���ɷ���ʽ��֪Fe3+Ϊ0.2mol���ʻ�����Fe2+Ϊ0.35mol-0.2mol=0.15mol����FeO•��Fe2O3���ʵ���֮��Ϊ0.15mol��0.1mol=3��2����Ļ�ѧʽΪ3FeO•2Fe2O3������Fe7O9����
��1���Ļ�ѧʽ��3FeO•2Fe2O3������Fe7O9��������Ũ�����ܽ�����ӷ�Ӧ����ʽ��3FeO•2Fe2O3+18H+=3Fe2++4Fe3++9H2O��
�ʴ�Ϊ��3FeO•2Fe2O3������Fe7O9����3FeO•2Fe2O3+18H+=3Fe2++4Fe3++9H2O��
��2�����ʵ����֤��ҺA�н���X���ӵļ�̬��ȡ����A��Һ���μ����軯����Һ������ɫ��������Fe2+����ȡ����A��Һ���μ�KSCN��Һ����Ѫ��ɫ����Fe3+��
�ʴ�Ϊ��ȡ����A��Һ���μ����軯����Һ������ɫ��������Fe2+����ȡ����A��Һ���μ�KSCN��Һ����Ѫ��ɫ����Fe3+��
��3��Fe���л�ԭ�ԣ�CO2��+4��̼���������ԣ����ܷ���������ԭ��Ӧ���ò²������
�ʴ�Ϊ��������Fe���л�ԭ�ԣ�CO2��+4��̼���������ԣ����ܷ���������ԭ��Ӧ��
��4������Ԫ��Fe��̼Ԫ���γɵĻ�����Fe3C���ֳ�Ϊ��̼�壮��ҵ�Ͽ��÷����Ŀ�ʯ��Ԥ�Ⱥ��CH4��H2���������һ���¶ȡ�ѹǿ�����·�����Ӧ���Ʊ����÷�Ӧ����ʽΪ��3Fe7O9+13H2+7CH4=7Fe3C+27H2O��Fe3C��������ˮ����ˮ��ϡ�ᣬ�������ȵ�Ũ���ᣬFe3C���ȵ�Ũ���ᷴӦ�Ļ�ѧ����ʽ��Fe3C+22HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$3Fe��NO3��3+CO2+13NO2��+11H2O��
�ʴ�Ϊ��3Fe7O9+13H2+7CH4=7Fe3C+27H2O��Fe3C+22HNO3��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$3Fe��NO3��3+CO2+13NO2��+11H2O��
���� ���⿼��������ƶϣ����ڼ������ƶϣ���������Ԫ�ػ��������ʣ����ض�������ԭ��Ӧ�Ŀ��飬�Ѷ��еȣ�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
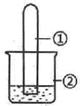 ����ͼ��ʾװ�ý�������ʵ�飬ʵ������Ԥ�������һ�µ��ǣ�������
����ͼ��ʾװ�ý�������ʵ�飬ʵ������Ԥ�������һ�µ��ǣ�������| ѡ�� | ���е����� | ���е����� | Ԥ��װ�������� |
| A | NO2 | ����ˮ | �Թܳ�����ɫ��Һ |
| B | SO2 | ��ɫʯ����Һ | ��Һ��Ϊ��ɫ |
| C | HCHO | ����Cu��OH��2����Һ | ������ɫ���� |
| D | CH3Cl | AgNO3��Һ | ������ɫ���� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ũ��ˮ�д��ڷ�Ӧ Br2+H2O?HBr+HBrO | |
| B�� | ������Һ�Լ��Ե�ԭ���� CO32-+2H2O?H2CO3+OH- | |
| C�� | ��ˮ����ȡ�廹���õ��ķ�Ӧ Cl2+2Br-�T2Cl-+Br2 | |
| D�� | �������������Ҫ��Ӧ��3Br2+3Na2CO3�T5NaBr+NaBrO3+3CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵķ����ᴿ����֮һΪ��ɸ�֡����磺����--�������ᴿ����Һ--���˷��룬�����Ͼ����������������ӵ�ֱ����Сѡ����к��ʿ��ġ�ɸ�ӡ� | |
| B�� | ����ƿ����Ͳ�͵ζ����϶�����ʹ���¶ȣ�����ƿ�ޡ�0���̶ȣ���Ͳ�͵ζ����С�0���̶ȣ�ʹ��ʱ�ζ���ˮϴ������ϴ��������ƿˮϴ������ϴ | |
| C�� | ��ҵ�ϵ�ⱥ��ʳ��ˮʱ��Ϊ����ֹ�����֮�䷴Ӧ�������������ӽ���Ĥ���������������� | |
| D�� | �����£�Ũ�Ⱦ�Ϊ0.1 mol•L-1Na2S2O3��H2SO4��Һ����ȡ5 mL��10 mL��Na2S2O3��Һ�ֱ���10 mL��H2SO4��Һ��Ϸ�Ӧ������֤Na2S2O3Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ʵ������ | ���� |
| A | ��Ũ��ˮ�ӵ�ʢ��AgCl������Թ��� | AgCl������ȫ�ܽ� | ������Һ��c��Ag+��•c��Cl-�� ��Ksp��AgCl�� |
| B | ��FeI2��Һ��ͨ������������������Ӧ�����Һ�еμ�KSCN��Һ | ��Һ��Ϊ��ɫ | Cl2�ܽ�Fe2+������Fe3+ |
| C | ����崿���еμ�����Ũ���ᣬ������������ͨ�뱽������Һ | ��Һ����� | ���ԣ����̼����� |
| D | �����ݵ�������Һ�зֱ�μӱ���NaCl��Һ��CuSO4��Һ | ���й������� | �����ʾ��������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �з����ת�����ϣ��������̫���� | |
| B�� | ��װ���Ͼ�����ϩ������������ɻ�����Ⱦ | |
| C�� | ��ʯ�Ҷ�úȼ���γɵ�������������ʯ�� | |
| D�� | �з���Ч�����������ڼ������ٶԻ��ʵ�ʹ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
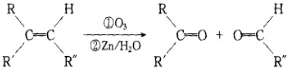
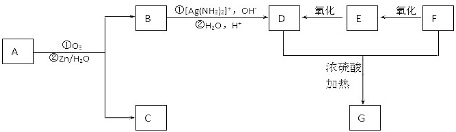
 +2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O��
+2H2O����Ӧ������������Ӧ��D��̼�����Ʒ�Ӧ�Ļ�ѧ����ʽ��HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2��+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
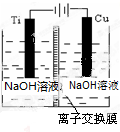 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����| ����a | ��̿���ڸ��������»�ԭCuO |
| ����b | �������ǻ�ԭ���Ƶ�Cu��OH��2�Ʊ�Cu2O |
| ����c | ��ⷨ����ӦΪ2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2�� |
| ����d | ���£�N2H4����ԭ���Ƶ�Cu��OH��2 |
| ��� | 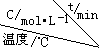 | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com