
 .
. +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$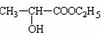 +H2O,
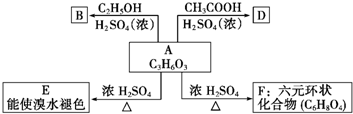
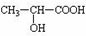
+H2O,分析 A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,可判断A为CH3CH(OH)COOH,而A被氧化可得 ,不能发生银镜反应.A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为
,不能发生银镜反应.A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为 ,据此解答.
,据此解答.
解答 解:A在浓硫酸存在下既能和乙醇反应,又能和乙酸反应,说明A中既有羧基又有羟基.A催化氧化的产物不能发生银镜反应,可判断A为CH3CH(OH)COOH,而A被氧化可得 ,不能发生银镜反应.A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为
,不能发生银镜反应.A与乙醇发生酯化反应生成B为CH3CH(OH)COOCH2CH3,A与乙酸发生酯化反应生成D为CH3COOCH(CH3)COOH,A在浓硫酸、加热条件下生成E,E可以溴水褪色,应发生消去反应,E为CH2=CHCOOH,A在浓硫酸、加热条件下生成六原子环状化合物F,结合F的分子式可知,为2分子乳酸发生酯化反应生成环状化合物,故F为 .
.
(1)由上述分析可知,A为CH3CH(OH)COOH,E为CH2=CHCOOH,F为 ,
,
故答案为:CH3CH(OH)COOH;CH2=CHCOOH; ;
;
(2)A→B的化学反应方程式为: +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$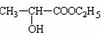 +H2O;
+H2O;
故答案为: +CH3CH2OH $→_{△}^{浓硫酸}$
+CH3CH2OH $→_{△}^{浓硫酸}$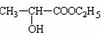 +H2O;
+H2O;
(3)A转化为B、D、F的反应均为酯化反应,而A转化为E的反应为消去反应,
故答案为:E.
点评 本题是框图型有机推断题,难度不大,其突破口是化合物A,从反应关系中确定A含有的官能团,进而确定A为乳酸,进而推断其它物质,是对有机化学知识的综合考查,能较好的考查学生的分析、思维能力.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
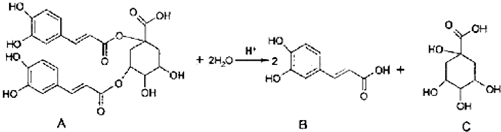
| A. | 1mol A和足量NaOH溶液反应,最多消耗11molNaOH | |
| B. | A在一定条件下能发生取代反应、加成反应和消去反应 | |
| C. | B能和浓溴水发生反应,1mol B最多消耗4molBr2 | |
| D. | C分子中含有手性碳原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 乙醇和HCl溶于水 | D. | HCl和NaCl溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
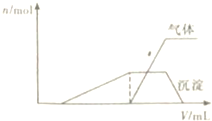 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )偶联可由下列两个途径制备有机化合物Ⅵ.
)偶联可由下列两个途径制备有机化合物Ⅵ.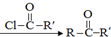
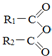 +H2O→R1-COOH+R2-COOH
+H2O→R1-COOH+R2-COOH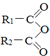

 .
. 、
、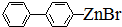 .
.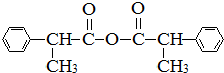 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
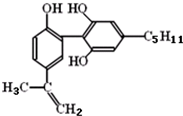
| A. | 该分子中所有碳原子一定共存于同一平面内 | |
| B. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| C. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com