


科目:高中化学 来源: 题型:
| A、Fe[Ar]3d54s3 |
| B、F-1s22s22p5 |
| C、k[Ar]3d1 |
| D、p 1s22s22p63s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类是人体获得能量的唯一来源 |
| B、没有蛋白质就没有生命 |
| C、油脂在人体内酶的作用下,可重新合成人体所需的脂肪等物质 |
| D、人体所需的菅养素主要有糖类、油脂、蛋白质、无机盐、维生素和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 15 |
| 16 |
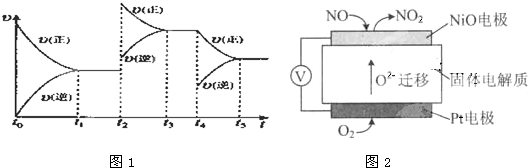
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度、体积不变,充入氩气 |
| B、体积不变,对体系加热 |
| C、温度、体积不变,充入氯气 |
| D、温度不变,增大容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、玻璃容器可长期盛放各种酸 |
| B、硝酸常用作金属铜加工前的酸洗 |
| C、碳酸钠可用于治疗胃酸过多 |
| D、三氧化二铁常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ag+、ClO-、Cl- |
| B、Al3+、Mg2+、Br-、Cl- |
| C、NH4+、NO3-、Fe2+、SO42- |
| D、K+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中一定有化合价的升降 |
| B、有氧元素参加的反应一定是氧化还原反应 |
| C、氧化剂在反应中失去电子 |
| D、还原剂在反应中化合价升高,被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com