
下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是
A.K、Na、Li B.Al、Mg、Na C.N、O、C D.Cl、S、P
科目:高中化学 来源: 题型:
下列说法中正确的是 )。
A.凡有能量变化的过程都是化学变化
B.吸热反应只有在加热的条件下才能进行
C.放热反应可能需要在加热的条件下才能进行
D.化学反应中的能量变化都只以热能的形式表现出来
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO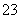 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO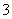 )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
(1)一定条件下,2.3 g的Na与O2完全反应生成3.6 g产物时失去的电子数为________。
(2)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________(填字母)。
a.溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
b.溶液中有Fe2+、Al3+,不溶物为Cu、Fe
c.溶液中有Fe3+、Al3+,不溶物为Cu
d.溶液中有Fe2+,不溶物为Cu、Al
(3)将一定质量的铁、铝、铜合金,加入1 L一定物质的量浓度的硝酸中,合金完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5 mol·L-1,c(Cu2+)=0.3 mol·L-1,c(Al3+)=0.2 mol·L-1,c(NO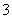 )=2 mol·L-1,则混合物中铁的质量最少为________。
)=2 mol·L-1,则混合物中铁的质量最少为________。
(4)铁的某种氧化物的化学式表示为FexO(x<1),已知铁元素在该氧化物中的质量分数为75%,则x=______(精确至0.01)。
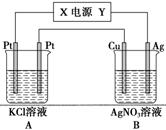
(5)Na—Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变。
①若该正极的电极反应式表示为2Na++FeS+2e-===Na2S+Fe,则电池的负极反应式可表示为________________;充电时,阳极发生反应的物质是________。
②用该电池作电源,组成如图所示装置,若通电5 min时,铜电极质量增加1.08 g,则该电源电极X名称为________。图中装置A、B的pH变化为A__________、B________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径 B.x的电负性大于y的电负性
C.x的能层数性等于y的能层数 D.x的第一电离能小于y的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是 ( )
A、NH3 平面三角形 sp3杂化 B、CCl4 正四面体 sp3杂化
C、H2O V形 sp2杂化 D、CO32- 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)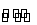 2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组对铝表面氧化膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(如空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期盛放或腌制咸菜。该小组同学设计了一个实验以探究其中的原因。他们的实验过程如下所示:
| 实验 | ||
| 编号 | 实验过程 | 实验现象 |
| 1 | 取一小片铝片于试管中,加入2 mL 1.0 mol·L-1盐酸 | 30 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 2 | 取一小片铝片于试管中,加入2 mL 0.5 mol·L-1硫酸 | 55 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 3 | 取一小片铝片于试管中,加入氯化铜稀溶液 | 3 min左右表面产生少量气泡,且铝表面析出一些红色固体 |
| 4 | 取一小片铝片于试管中,加入硫酸铜稀溶液 | 一直没有明显的变化 |
(1)你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是__________________________________。
(2)根据该实验现象,你认为铝制容器不能长期盛放或腌制咸菜的原因是__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com