
| A、1 mol FeI2与足量氯气反应时转移的电子数为2NA |
| B、2 L 0.5 mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| C、2 L 0.5 mol?L-1 FeCl3在沸水中充分反应可制得1molFe(OH)3胶体 |
| D、用0.75molH2SO4,1.5molNaOH与适量Al反应最多可制取2molAl(OH)3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
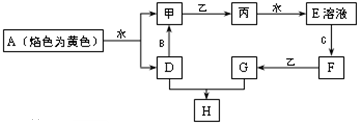
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22g CO2中含有NA个氧原子 |
| B、通常状况下,11.2 L氮气中含有NA个氮原子 |
| C、2mol铝与足量稀盐酸反应生成3NA个氢气分子 |
| D、标准状况下,22.4 L H2O中含有NA个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在通风橱中制取SO2不用NaOH溶液吸收尾气 |
| B、回收利用废旧电池 |
| C、用燃气热水器代替太阳能热水器 |
| D、将实验室的有机废液直接倒入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液:CH3COOH+NH3═CH3COONH4 |
| B、石灰乳跟盐酸反应:H++OH-═H2O |
| C、硫酸钡溶于醋酸:BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com