
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
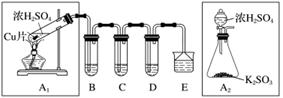
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为__________,C中反应的离子方程式为________________________________________________________________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是____________________________________________________
(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO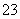 、SO
、SO 、HSO
、HSO 等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO
等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol·L-1盐酸、2 mol·L-1 HNO3、1 mol·L-1 BaCl2溶液、1 mol·L-1 Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO 和HSO
和HSO ,完成下表的实验操作、预期现象和结论:
,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1 mol·L-1 BaCl2溶液滴入小烧杯中直至过量 | 若出现白色浑浊,则溶液中存在SO |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体______________ | |
| 步骤3: |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量是 ( )
A.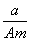 (A-N+m)mol B.
(A-N+m)mol B.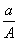 (A-N)mol
(A-N)mol
C.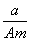 (A-N)mol D.
(A-N)mol D.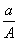 (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常见有机物的说法正确的是( )
A.乙炔的化学性质与乙烯的相似,也能形成高分子化合物
B.甲烷是水煤气的主要成分
C.不粘锅的原料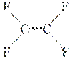 为烃类化合物
为烃类化合物
D.葡萄糖、鸡蛋清均能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
将3.6 g铁铜混合粉末,投入100 mL c mol·L-1的稀硝酸中,金属粉末与硝酸恰好完全反应(还原产物只有NO),向反应后的溶液中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、灼烧至恒重后称量为4.8 g。则c值不可能为( )
A.1.2 B.1.75 C.2.3 D.1.95
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表:
| 实验操作 | 实验现象 |
| Ⅰ.用砂纸打磨后的镁带与沸水反应,再向反应后溶液中滴加酚酞 Ⅱ.向新制的H2S饱和溶液中滴加新制的氯水 Ⅲ.钠与滴有酚酞溶液的冷水反应 Ⅳ.镁带与2 mol·L-1的盐酸反应 Ⅴ.铝条与2 mol·L-1的盐酸反应 Ⅵ.向AlCl3溶液滴加NaOH溶液至过量 | A.浮于水面,熔成一个小球,在水面上无定向 移动,随之消失,溶液变红色 B.产生气体,可在空气中燃烧,溶液变成浅红 色 C.反应不十分强烈,产生的气体可以在空气中 燃烧 D.剧烈反应,产生可燃性气体 E.生成白色胶状沉淀,进而沉淀消失 F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:___________________________________________________。
(2)实验用品:仪器①______________、②____________、③____________、④试管夹、⑤镊子、⑥小刀、⑦玻璃片、⑧砂纸、⑨胶头滴管等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、新制的饱和H2S溶液、AlCl3溶液、NaOH溶液等。
(3)请你写出上述的实验操作与对应的现象
Ⅰ________、Ⅱ________、Ⅲ________、Ⅳ________、Ⅴ________、Ⅵ________。(用A~F表示)
写出实验操作Ⅱ、Ⅵ的离子反应方程式
实验Ⅱ________________________________________________________________________;
实验Ⅵ________________________________________________________________________。
(4)实验结论:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关电化学知识的描述正确的是( )
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C.原电池的两极一定是由活动性不同的两种金属组成
D.从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( )
A.A>B>C>D>E B.A>C>D>B>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
科目:高中化学 来源: 题型:
控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
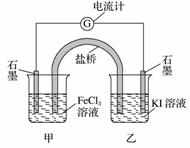
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氧化镁常用于制药工业,还是重要的绿色阻燃剂。
(1)氢氧化镁为白色晶体,难溶于水,易溶于稀酸和铵盐溶液,为治疗胃酸过多的药物。
写出氢氧化镁溶于铵盐溶液发生反应的离子方程式________________________________________________________________________。
(2)氢氧化镁在350 ℃时开始分解,500 ℃时分解完全。请分析氢氧化镁可用于阻燃剂的原因是(至少写两点)
________________________________________________________________________。
(3)某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。
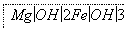
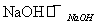
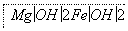
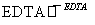
已知EDTA只能与溶液中的Fe2+反应生成易溶于水的物质,不与Mg(OH)2反应。虽然Fe(OH)2难溶于水,但步骤②中随着EDTA的加入,最终能够将Fe(OH)2除去并获得纯度高的Mg(OH)2。请从沉淀溶解平衡的角度加以解释______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com