
下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )
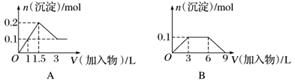
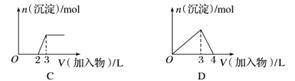
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
答案 A
解析 A项,Ba(OH)2和NaAlO2中加入H2SO4,发生的反应依次为Ba2++2OH-+2H++SO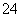 ===BaSO4↓+2H2O、AlO
===BaSO4↓+2H2O、AlO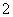 +H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,所以加1 L H2SO4时,Ba(OH)2反应完,再加0.5 L H2SO4时AlO
+H++H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,所以加1 L H2SO4时,Ba(OH)2反应完,再加0.5 L H2SO4时AlO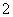 参加反应,再加1.5 L H2SO4时,Al(OH)3全部溶解,A正确;B项,向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH
参加反应,再加1.5 L H2SO4时,Al(OH)3全部溶解,A正确;B项,向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的NaOH溶液,发生的反应依次是Al3++3OH-===Al(OH)3↓、OH-+NH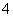 ===NH3·H2O、Al(OH)3+OH-===AlO
===NH3·H2O、Al(OH)3+OH-===AlO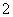 +2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH的量之比为3∶1,而图像上看到的是1∶1,B错误;C项,向烧碱溶液中滴加明矾溶液,发生的反应依次是Al3++4OH-===AlO
+2H2O,所以沉淀Al3+和溶解Al(OH)3所用NaOH的量之比为3∶1,而图像上看到的是1∶1,B错误;C项,向烧碱溶液中滴加明矾溶液,发生的反应依次是Al3++4OH-===AlO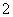 +2H2O、Al3++3AlO
+2H2O、Al3++3AlO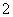 +6H2O===4Al(OH)3↓,C错误;D项,AlCl3溶液中滴加过量氨水,沉淀不会溶解,D错误。
+6H2O===4Al(OH)3↓,C错误;D项,AlCl3溶液中滴加过量氨水,沉淀不会溶解,D错误。


科目:高中化学 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为________、________;
(2)XZ2与YZ2分子的空间构型分别是________和________,相同条件下两者在水中的溶解度较大的是________(写分子式),理由是____________________________________
________________________________________________________________________
________________________________________________________________________;
(3)Q的元素符号是________,它属于第________周期,它的核外电子排布式为________,在形成化合物时它的最高化合价为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO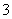 、ClO-
、ClO-
B.0.1 mol·L-1 FeCl3溶液:NH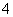 、H+、I-、SCN-
、H+、I-、SCN-
C.0.1 mol·L-1 Na2CO3溶液:K+、Ca2+、HCO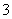 、SO
、SO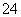
D.使酚酞变红色的溶液:Na+、Ba2+、NO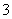 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
在做铝的燃烧实验时,用坩埚钳夹住一小块铝箔,在酒精灯上加热至其熔化,会看到的现象是铝箔熔化,失去光泽,但熔化的铝并不滴落。原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.向氯化铝溶液中通入过量氨气:4NH3+Al3++2H2O===AlO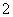 +4NH
+4NH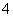
B.将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO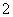 +H2↑
+H2↑
C.向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO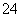 +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO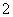 +2H2O
+2H2O
D.向NaAlO2溶液中通入足量CO2:AlO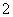 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
MgSO4·7H2O是一种重要的化工原料。某研究性学习小组设计了利用菱镁矿石(主要成分是MgCO3,并含有MnCO3、SiO2杂质)制取MgSO4·7H2O的实验,流程如下。


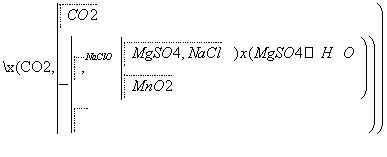
(1)第①步研磨的目的是____________________,所得滤液主要含__________________、__________________等溶质。
(2)第②步反应的离子方程式为_________________________________。
(3)第③步浓缩结晶后,要经过________、洗涤、干燥等步骤才可得到MgSO4·7H2O,洗涤沉淀的基本操作是____________________________________________。
(4)若制得MgSO4·7H2O质量为82.00 g,测得MnO2质量为1.74 g,且测得第①步滤渣质量为4.70 g,忽略各物质在溶液中的溶解损失,可计算出菱镁矿石中MgCO3的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是______________________________
________________________________________________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是__________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子键的叙述中正确的是( )
A.离子化合物中只含有离子键
B.共价化合物中可能含离子键
C.含离子键的化合物不一定为离子化合物
D.共价化合物中不含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com