
分析 2FeCl3+Fe═3FeCl2反应中Fe元素化合价由0价变为+2价、另一部分Fe元素化合价由+3价变为+2价,转移电子总数为2;
C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,所以碳作还原剂、硝酸作氧化剂,转移电子数是4,据此分析解答.
解答 解:2FeCl3+Fe═3FeCl2反应中Fe元素化合价由0价变为+2价、另一部分Fe元素化合价由+3价变为+2价,转移电子总数为2,其转移电子方向和数目为 ;
;
C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O反应中C元素化合价由0价变为+4价、N元素化合价由+5价变为+4价,得失电子最小公倍数是4,则转移电子数为4,所以电子转移的方向和数目为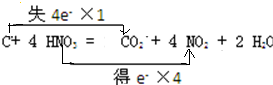 ;
;
故答案为: ;
;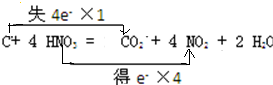 .
.
点评 本题考查氧化还原反应,侧重于基本概念、电子转移表示方法的考查,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
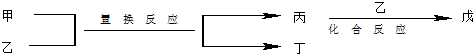
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| NH3 | O2 | NO | H2O | NO2 | |
| Mg | CO2 | C | MgO | CO | |
| C | H2O | CO | H2 | CO2 | |
| FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合物注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯的外焰上加热变黑后,插入乙醇溶液中铜丝又恢复到原来的红色 | |
| C. | 往试管中注入2mLCuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀产生 | |
| D. | 向淀粉溶液中加入稀硫酸加热,一段时间后,再加入银氨溶液检验是否水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 名 称 | 抑酸成分 | 主要成分含量/片 |
| ① | INDICALM | CaCO3 | 250mg |
| ② | Stamachease | Al(OH)3 | 250mg |
| ③ | Fash digestion | MgO | 250mg |
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用明矾对自来水进行杀菌消毒 | |
| B. | 钠长期放置在空气中,最终将变成碳酸氢钠 | |
| C. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| D. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
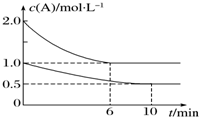 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
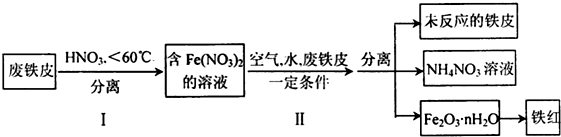
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com