
【题目】根据已学《物质结构与性质》的有关知识,回答下列问题:
(1)如图所示是元素周期表中第一、第二周期10种元素的某些性质的一组数据(所列数据的单位相同),除带“…”的四种元素外,其余元素都给出了该种元素的全部该类数据。
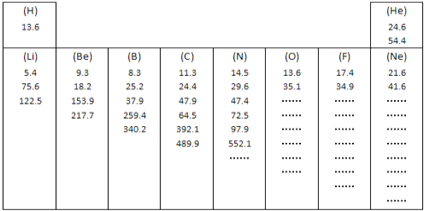
有些元素的逐级电离能中个别地方增大的比例(倍数)特别大,形成“突跃”,由此可以证明原子结构中_______________________的结论。根据这个规律,你认为氧元素8个电离能数据中出现“突跃”的数据应该是第________个。
(2)在①苯 ②CH3OH ③HCHO ④CS2 ⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_____(填序号),易溶于水的有_____(填序号),理由是:____________。
(3)N≡N键的键能为946kJ·mol-1,N—N键的键能为193kJ·mol-1,则一个π键的平均键能为__________,说明N2中________键更稳定(填“σ”或“π”)。
(4)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解,得到深蓝色的透明溶液,写出有关化学反应的离子方程式___________、____________。
【答案】原子核外电子分能层排布 7 ①③ ②③ CH3OH、HCHO均为极性分子而溶剂水也为极性分子,相似相溶,且CH3OH、HCHO与水分子间可以形成氢键 376.5kJ·mol-1 π Cu2++2NH3H2O═Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
【解析】
(1)由表中数据可知,“突跃”数据与失去不同能层的电子所需的能量一致,数据表示为电离能,说明原子核外电子分层排布,失去不同能层的电子时电离能发生跃迁,故氧元素8个数据中出现“突跃”的数据应该是第7个,
故答案为:原子核外电子分层排布;7;
(2)①苯中碳原子采取sp2杂化;②CH3OH中碳原子采取sp3杂化;③HCHO中碳原子采取sp2杂化;④CS2中碳原子采取sp杂化;⑤CCl4中碳原子采取sp3杂化,所以碳原子采取sp2杂化的分子有①③;CH3OH、HCHO与水分子间可以形成氢键,CH3OH、HCHO均为极性分子而溶剂水也为极性分子,根据相似相溶规律可知CH3OH、HCHO易溶于水;
故答案为:①③;②③;CH3OH、HCHO均为极性分子而溶剂水也为极性分子,相似相溶,且CH3OH、HCHO与水分子间可以形成氢键
(3)N≡N中含有2个π键,1个σ键,已知N≡N键能为946kJ/mol,N-N单键键能为193kJ/mol,则1个π键的键能为![]() kJ/mol=376.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定。
kJ/mol=376.5kJ/mol,则N2中的π键键能大于σ键键能,较稳定。
答案为:376.5kJ·mol-1;
(4)氨水和硫酸铜反应生成氢氧化铜蓝色沉淀,当氨水过量时,氨水和氢氧化铜反应生成可溶性的铜氨络合物,所以难溶物溶解得到深蓝色的透明溶液:Cu2++2NH3H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
故答案为:Cu2++2NH3H2O═Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示。下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漳州市海水资源丰富,漳浦盐场是福建省第三大国有盐场,盐田面积达700万平方米,每年产盐5万多吨。海水化学资源(主要为NaCl和MgSO4及K、Br等元素)的利用具有非常广阔的前景。

回答下列问题:
⑴NaClO3中氯的化合价_____________。
⑵在a、b、c、d提取镁的过程中,没有涉及的化学反应类型是_________(填序号)。
①分解反应 ②化合反应 ③复分解反应 ④置换反应
⑶苦卤中通入氯气发生的主要离子反应方程式为___________________________________。⑷步骤a中的沉淀剂是____________________。
⑸步骤d中,电解熔融MgCl2得到的镁需要在保护气中冷却,下列气体可以作为保护气的是____________(填序号)。
①N2 ②H2 ③CO2 ④空气
⑹假设该海域海水中MgCl2浓度9.5×10-3g·L-1 ,欲获得24g金属镁需要________L海水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
浓度 时间 反应条件 |
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
①研究小组在设计方案时,考虑了浓度、 ______ 、 ______ 因素对过氧化氢分解速率的影响。(2)另一研究小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响,限选试剂与仪器![]() 、
、![]() 、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图![]() 要求所测得的数据能直接体现反应速率大小_________
要求所测得的数据能直接体现反应速率大小_________
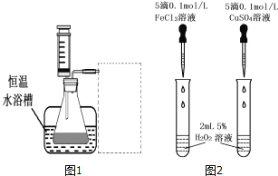
(3)对于H2O2分解反应,![]() 也有一定的催化作用。为比较Fe3+和
也有一定的催化作用。为比较Fe3+和![]() 对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察 ____________ ,比较得出结论。
②有同学提出将![]() 的
的![]() 溶液改为
溶液改为![]() 更为合理,其理由是 _________ 。
更为合理,其理由是 _________ 。
(4)已知![]() 溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
猜想1:真正催化分解H2O2的是![]() 溶液中的Fe3+
溶液中的Fe3+
猜想2:真正催化分解H2O2的是 __________________
完成表格,验证猜想:
所需试剂 | 操作及现象 | 结论 |
_________ | __________ | Cl-对H2O2分解无催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中的溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1
D. (4)图显示M中的溶质为NaOH和Na2CO3,二者的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1b.+29.7 mol·L-1
c.-20.6 mol·L-1d.-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)硅酸盐可以改写成氧化物的形式,将下列硅酸盐改写成氧化物的形式:
①镁橄榄石(Mg2SiO4):____。
②高岭石[Al2(Si2O5)(OH)4]:____。
(2)写出下列反应的方程式:
①漂白粉露置于空气中较长时间后失效的化学方程式: _________________________。
②Cl2通入NaOH溶液中,发生反应的离子方程式:________________________。
③NO2与水反应的化学方程式为___________,该反应中氧化剂与还原剂的物质的量之比为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.标准状况下,22.4L氦气含有所含的原子数约为6.02×1023
B.标准状况下,aL的二氧化碳和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
C.22 g二氧化碳与标准状况下11.2 L 氯化氢气体含有的分子数相同
D.标准状况下,2.24L CCl4中含有的原子数约为0.5×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B.![]() =10-12的溶液:NH4+、Na+、SO42-、Cl-
=10-12的溶液:NH4+、Na+、SO42-、Cl-
C.0.1 mol·L-1Na2SO3溶液:NH4+、K+、ClO-、Cl-
D.0.1 mol·L-1 FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com