
| 元素 | 有关信息 |
| X | 在元素周期表中原子半径最小 |
| Y | 最外层电子数是次外层的2倍 |
| Z | 元素的主要合价为一2价 |
| M | 其单质及化合物的焰色反应呈黄色 |
| N | 与Y同主族,其单质为半导体 |
 ;M2Z中所含化学键类型是离子键.
;M2Z中所含化学键类型是离子键.分析 短周期元素X、Y、Z、M、N原子序数依次增大,X在自然界中原子半径最小,则X为氢元素;Y最外层电子数是次外层的2倍,则Y原子有2个电子层,最外层电子数为4,故Y为碳元素;M其单质及其化合物的焰色为黄色,则M为Na元素;Z元素的主要化合价为-2价,处于ⅥA族,原子序数小于钠元素,则Z为氧元素;N与Y同主族,其单质为半导体材料,则N为Si元素,据此答题;
解答 解:短周期元素X、Y、Z、M、N原子序数依次增大,X在自然界中原子半径最小,则X为氢元素;Y最外层电子数是次外层的2倍,则Y原子有2个电子层,最外层电子数为4,故Y为碳元素;M其单质及其化合物的焰色为黄色,则M为Na元素;Z元素的主要化合价为-2价,处于ⅥA族,原子序数小于钠元素,则Z为氧元素;N与Y同主族,其单质为半导体材料,则N为Si元素,
(1)X2Z为H 2O,其的电子式是 ;Na2O为,其中所含化学键类型是离子键,
;Na2O为,其中所含化学键类型是离子键,
故答案为: ;离子键;
;离子键;
(2)Y为碳元素,N为Si元素,同主族自上而下非金属性减弱,故非金属性C>Si,反应CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-,表明碳酸的酸性比硅酸强,可以说明C的非金属性强,
故答案为:强;CO 2+H 2O+SiO32-=H 2SiO 3↓+CO 32-;
(3)YX4的结构简式为CH4,CH4分子里各原子的空间分布具有正四面体结构;在光照的条件下,将1molCH4 与1molCl 2 混合充分反应后,得到的产物有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氢,共有5种,
故答案为:CH4;正四面体;5;
点评 本题主要考查元素周期律和元素周期表及元素的性质,元素推断是解题的关键,中等难度,解题是注意根据原子结构及元素周期表进行元素推断.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 24.1% | B. | 25.9% | C. | 40.3% | D. | 48.1% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1 | B. | 0 | C. | +1 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类和蛋白质都是人体重要的营养物质 | |
| B. | 鸡蛋白可以水解得到氨基酸 | |
| C. | 液化石油气和天然气的主要成分都是甲烷 | |
| D. | 利用油脂在碱性条件下的水解,可以制得肥皂和甘油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H和D互为同位素 | B. |  与 与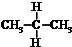 互为同分异构体 互为同分异构体 | ||
| C. | CH3CH3和CH3CH2CH3互为同系物 | D. | O2和O3互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴 | |
| B. | 石油裂化的主要目的是提高汽油的产量 | |
| C. | 煤干馏的产品很多,是一个化学变化 | |
| D. | 海水提镁的过程为:MgCl2(aq)$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{煅烧}{→}$MgO$\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
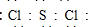 ,Y2W2的结构式为Cl-S-S-Cl.
,Y2W2的结构式为Cl-S-S-Cl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的电负性大于Y的电负性 | B. | X的原子半径大于Y的原子半径 | ||
| C. | X的氧化性大于Y的氧化性 | D. | X的第一电离能大于Y的第二电离能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com