
| A.氢铝化合物与水反应生成氢氧化铝和氢气 |
| B.氢铝化合物中铝显+3价,氢显-1价 |
| C.铝与水蒸气在高温下反应可生成氢铝化合物 |
| D.氢铝化合物具有强还原性 |
科目:高中化学 来源:不详 题型:单选题
| A.1组 | B.2组 | C.3组 | D.4组 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 较大量存在的含金属元素的离子 | 检验方法 |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.利用纯铝制造运-20发动机 |
| B.用镁铝合金制造运-20座椅 |
| C.用氧化铝制造运-20电器线路的导线 |
| D.用普通钢制造运-20灭火器的外壳 |
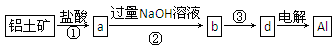
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe2O3是红棕色粉末 | Fe2O3常用作红色涂料 |
| B | SiO2是两性氧化物 | SiO2可和HF反应 |
| C | Al2O3难溶于水 | Al2O3可用作耐火材料 |
| D | SO2有氧化性 | SO2可使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
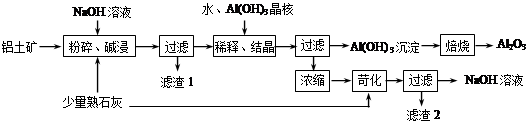
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MgO、Al2O3、SiO2分别是碱性氧化物、两性氧化物和酸性氧化物 |
| B.三者均可以采用单质在空气中燃烧或加热的方法制得 |
| C.MgO和Al2O3可以作为耐高温材料,SiO2可用于制作光导纤维 |
| D.分别电解熔融状态的MgO、Al2O3、SiO2可以制得Mg、Al、Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com