
| A. | 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)<V(NaOH) | |
| B. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | |
| C. | 常温下将pH=3稀醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| D. | 25℃时,amol/L一元酸与bmol/LNaOH等体积混合后,pH=7,所得混合溶液中一定有c(A-)=c(NA+) |
分析 A.醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量;
B.醋酸加水稀释促进醋酸电离,但溶液中氢离子浓度减小;
C.醋酸是弱电解质,醋酸中存在电离平衡,导致醋酸稀释10倍后,溶液的pH<原pH+1;
D.25℃时,amol/L一元酸与bmol/LNaOH等体积混合后生成盐和水,溶液中存在电荷守恒.
解答 解:A.醋酸溶液与NaOH溶液恰好反应时溶液呈碱性,若使溶液呈中性,则酸过量,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)>V(NaOH),故A错误;
B.醋酸加水稀释促进醋酸电离,但溶液中氢离子增大程度小于溶液体积增大程度,所以氢离子浓度减小,溶液的pH增大,故B错误;
C.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,醋酸中存在电离平衡,导致稀释后醋酸溶液的pH小于4,故C错误;
D.25℃时,amol/L一元酸与bmol/LNaOH等体积混合后生成盐和水,溶液中存在电荷守恒,一元酸HA,则电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(A-),pH=7,c(H+)=c(OH-),所得混合溶液中一定有c(A-)=c(Na+),故D正确;
故选D.
点评 本题考查弱电解质电离平衡、酸碱混合的定性判断、电解质溶液中离子浓度关系,为高考常见题型,题目难度中等,本题注意从溶液电中性的角度比较溶液离子浓度的大小关系,掌握基础是解题关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光柱 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该星球表面温度很高 | |
| B. | 该星球表面温度很低 | |
| C. | 低温下稳定性CH2=CHOH>CH3CHO | |
| D. | 该反应中CH2=CHOH化学键断裂吸收能量大于CH3CHO化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应是放热反应的可逆反应,升高温度v(正)>v(逆) | |
| B. | 升高温度或使用催化剂是通过增加活化分子百分数而使反应速率加快 | |
| C. | 勒夏特列原理只使用于可逆反应,不使用于溶解和弱电解质的电离 | |
| D. | △G=△H-T△S适合任意条件的化学反应进行的方向判据 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
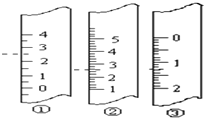 某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
某同学用0.10mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com