
【题目】25℃时,下列溶液中的微粒浓度的关系正确的是
A. pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol·L-1
B. 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中的c(![]() ):①<②
):①<②
C. pH=3的0.1mol·L-1NaHC2O4溶液中:![]()
D. 0.1mol·L-1的Na2CO3溶液中:![]()
科目:高中化学 来源: 题型:
【题目】能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是( )。
A.天然气是二次能源 B.石油是二次能源
C.电能是一次能源 D.水力是一次能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、A1,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为________________。
(2)“溶解”时放出的气体为_________(填化学式)。
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为______________。
(4)己知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为__________;过滤2所得滤渣的成分为___________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式______________。
(6)若加热不充分,则制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·y Ni(OH)2。现称取8.29g xNiOOH·y Ni(OH)2样品溶于稀硫酸,搅拌至溶液澄清,定容至200mL,从中移取20.00 mL,用0.010mol·L-1的KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4 标准溶液 20.00 mL。已知 5Ni2++MnO4-+8H+=5Ni3++Mn2++4H2O,则x=_________,y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离混合物的操作中正确的是( )
A.用分液的方法分离水和四氯化碳
B.用分液的方法分离植物油和汽油
C.用过滤的方法分离酒精和水
D.用过滤的方法分离四氯化碳和碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
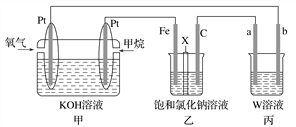
(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,可逆反应A(s)+2B(g) ![]() C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
C(g)+D(g)达到化学平衡状态,以下说法不正确的是( )
A.v (B)正=2 v (C)逆 B.容器内每消耗1 molD,同时生成1molD
C.容器内气体的密度不变 D.向容器中加入少量A,平衡正向移动,K不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25 mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述中,正确的是( )
A.硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位
B.硅的化学性质不活泼,在常温下不与任何物质反应
C.硅在电子工业中是最重要的半导体材料
D.硅的性质很稳定,能以单质的形式存在于自然界中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com