
下列各组离子中能大量共存的是
A.无色溶液中:K+、Na+、MnO4﹣、SO42﹣
B.在酸性溶液中:Mg2+、Na+、SO42﹣、Cl﹣
C.能使pH试纸变蓝色的溶液:Cl﹣、HCO3﹣、SO42﹣、NH4+
D.碱性溶液中:K+、Cl﹣、NO3﹣、Cu2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
高聚物••--CH2—CH2—CH2-••是用下列何种物质聚合而成的:
A.CH3-CH3 B.CH3-CH2-CH3 C.CH2=CH-CH3 D.CH2=CH2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:选择题
关于反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O下列说法不正确的是
A.HNO3在反应中既表现氧化性也表现出酸性
B.每生成22.4L NO(标准状况)有3mol电子转移
C.HNO3中N元素得电子,化合价升高
D.氧化剂和还原剂物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:填空题
无水AlC l3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
l3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

提示:2Fe(OH)3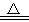 Fe2O3 + 3H2O
Fe2O3 + 3H2O
(1)铝在空气中有强的抗腐蚀性,原因是 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式为 ________________________。
(3)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,反应完后溶液呈碱性,此反应的离子方程式为
_____________________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
①写出上述除杂过程中涉及的离子方程式: 、 。
②产品中AlCl3的质量分数为(只列出计算式,不计算结果) 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高一上大考二化学卷(解析版) 题型:选择题
下列各溶液中n(Na+)与100 mL 0.1 mol/L Na2SO4溶液中n(Na+)相同的是
A.100 mL 0.1 mol/L NaCl 溶液
B.50 mL 0.2 mol/L NaNO3溶液
C.100 mL 0.1 mol/L NaHSO4溶液
D.200mL 0.2mol/L HCl溶液与100 mL 0.2 mol/L NaHCO3 溶液混合
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:填空题
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯, 请完成该反应的化学方程式
_____C+____ KMnO4+____H2SO4→____CO2↑+_____MnSO4+ ______K2SO4+_____H2O
(2)焦炭可用于制取水煤气,测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量。
反应的热化学方程式为_________________。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)  CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。
CH3OH(g) △H=akJ/mol 如表所列数据是反应在不同温度下的化学平衡常数(K)。

① 判断反应达到平衡状态的依据是___________。(填序号)
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2molCO和一定量的H2充入2L的密闭容器中,充分反应l0min后,达到平衡时测得c(CO)=0.2 mol/L,则以H2表示的反应速率v(H2)=________。
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在650℃下的燃料电池,其正极反应式:O2+2CO2+4e-=2CO32-,则负极反应式为___________________。
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层淸液,如此处理多次,可使BaSO4 全部转化为BaCO3发生反应:BaSO4(s) + CO32-(aq)=BaCO3(s) +SO42-(aq)。己知某温度下该 反应的平衡常数 K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积 Ksp=______。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:选择题
向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
则下列分析都正确的组合是
溶质的成分 | 对应图象 | 溶液中离子浓度关系 | |
A | NaHCO3、Na2CO3 | Ⅱ | c(CO32-)<c(HCO3-) |
B | NaOH、Na2CO3 | Ⅲ | c(OH-)>c(CO32-) |
C | Na2CO3 | Ⅳ | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
D | NaHCO3 | I | c(Na+)=c(HCO3-) |
查看答案和解析>>
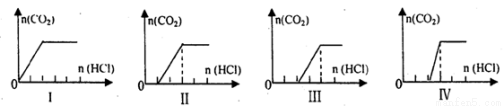
科目:高中化学 来源:2016-2017学年黑龙江省高一12月月考化学试卷(解析版) 题型:实验题
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验并进行产物的检验。(图中夹持及尾气处理装置均已略去)
(1)烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。装置B中发生反应的化学方程式是 。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 , 装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法____________________。
(4)若(3)实验中未检验到Fe3+的存在, 则可能的原因是______________(用离子方程式表示)。继续向溶液中滴加NaOH溶液,观察到的实验现象是 ,写出该过程中涉及到的化学方程式 、 。
则可能的原因是______________(用离子方程式表示)。继续向溶液中滴加NaOH溶液,观察到的实验现象是 ,写出该过程中涉及到的化学方程式 、 。
(5)若(3)实验中检验到Fe3+的存在,向溶液中通入一定量的SO2,观察到溶液由黄色变为浅绿色,写出反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上月考四化学卷(解析版) 题型:选择题
若以NA代表阿伏加德罗常数的值,下列说法中正确的是( )
A.1 mol Na 跟足量H2O反应得到电子的数目为NA
B.常温常压下,16 g甲烷(CH4)所含电子数为NA
C.标准状况下,22.4 L 酒精所含的分子数目为NA
D.常温常压下,6 g O2和26 g O3混合气体中的原子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com