
常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液。
(1)该溶液中存在的三个平衡体系是 、 、 。(用离子方程式表示)
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种 粒子是 。
粒子是 。
(5) 和 两种粒子数量之和比OH-多0.008mol。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届重庆市高三上12月考前测试化学卷(解析版) 题型:选择题
在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法中不正确的是:
A.Ⅰ 种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可 判断Fe是否被氧化
判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上段考二化学试卷(解析版) 题型:选择题
Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到l.l2LH2,Fe和Fe2O3均无剩余.为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A.2.25mol/L B.2mol/L C.4mol/L D.0.6mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高一上期中化学试卷(解析版) 题型:选择题
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,相同温度下测得容器内压强不变,若产物气体C的密度是原气体密度的4倍,则判断正确的是
A.两种单质A、B的摩尔质量之比是1:4
B.C中A、B两元素的原子个数比为3∶1
C.在生成物C中,A的质量分数为75%
D.反应前后的气体质量之比一定是1∶4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高一上期中化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子
B.1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒
C.14g CO中含有的原子数为NA
D.1.8 g 的NH4+离子中含有的电子数为 10NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:选择题
下列表述正确的是:
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:
c(NaOH)<c(Na2CO3)<c(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:选择题
用0.1026 mol·L-1 的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为:
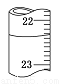
A.22.30 mL B.22.35 mL
C.23.65 mL D.23.70 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上阶段测二化学卷(解析版) 题型:选择题
重铬酸铵(NH4)2Cr2O7)是种受热易分解的盐,下列各组对重铬酸铵受热分解产物的判断,可能符合事实的是( )
①CrO3+NH3+H2O ②Cr2O3+NH3+H2O ③CrO3+N2+H2O ④Cr2O3+N2+H2O
A.①② B.②③ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省三明市高一上期中化学试卷(解析版) 题型:实验题
实验室需要配制一定量的1mol•L-1的氢氧化钠溶液和1mol•L-1的硫酸溶液.
(1)在配制氢氧化钠溶液和硫酸溶液的各步操作中,具体操作方法明显不同的有哪些?____________
A.取一定量的溶质 B.将溶质在烧杯中制成溶液 C.移液和洗涤 D.定容
(2)实验室需要配置230mL 1mol•L-1的NaOH溶液,其实验步骤为:
a.计算所需氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中,轻轻的振荡;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却至室温;
e.盖好瓶塞,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切;
根据上述信息回答问题:
①本实验操作步骤的正确顺序为____________
②实验中需要用到容量瓶的规格为____________
A.280mL B.200mL C.250mL D.230mL
③本实验中需要称量的氢氧化钠固体的质量为____________g
④如果实验过程中,溶解氢氧化钠固体的烧杯没有洗涤、定容时俯视观察液面对该氢氧化钠溶液的物质的量浓度的影响分别为____________、____________(填“偏高”、“偏低”或者“不变”)
(3)现需要配制500mL 1mol•L-1的硫酸,需用质量分数为98%、密度为1.84g•cm-3的浓硫酸_________mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com