
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
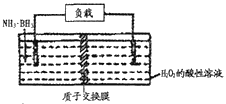
A. 正极附近溶液的pH减小
B. 电池工作时,H+通过质子交换膜向负极移动
C. 消耗3.1g氨硼烷,理论上通过内电路的电子为0.6ml
D. 负极电极反应为:NH3·BH3+2H2O-6e-= NH4++BO2-+6H+
【答案】D
【解析】H2O2为正极得到电子发生还原反应,电极反应式为3H2O2+6H++6e-═6H2O ,正极消耗氢离子,正极附近溶液的pH增大,故A错误;放电时,阳离子向正极移动,H+通过质子交换膜向正极移动,故B错误;负极电极反应式为NH3BH3+2H2O-6e-=NH4BO2+6H+,则消耗3.lg即0.1mol氨硼烷,理论上通过外电路的电子为0.6ml,故C错误; 根据电池工作时的总反应为:NH3BH3+3H2O2═NH4BO2+4H2O可知,左侧NH3BH3为负极失电子发生氧化反应,电极反应式为NH3·BH3+2H2O-6e-=NH4++BO2-+6H+,故D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验操作的主要仪器、注意事项及应用举例都正确的是( )
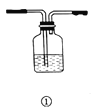

![]()
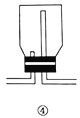
选项 | 实验操作 | 主要仪器 | 注意事项 | 应用举例 |
A | 洗气 | ① | 从长管进气,短管出气 | 用饱和碳酸氢钠溶液除去CO2气体中的SO2气体 |
B | 气体干燥 | ② | 从粗管进气,细管出气 | 用无水氯化钙作干燥剂干燥氨气 |
C | 分液 | ③ | 先将下层液体从下口放出,再将上层液体从下口放出 | 分离植物油和水的混合物 |
D | 气体收集 | ④ | 从长管进气,短管出气 | 收集氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律和元素周期表,下列推断不合理的是( )
A.第35号元素的单质在常温常压下是液体
B.第四周期第ⅤA族的元素为非金属元素
C.第二周期第ⅥA族的元素的最高化合价是+6
D.第七周期0族元素的原子序数为118
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
A. 4∶3∶2 B. 1∶2∶1 C. 1∶1∶2 D. 1∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正己烷、2甲基戊烷、( )、2,2二甲基丁烷、2,3二甲基丁烷。在上述有机物的有规律排列中,括号内填入的物质最适宜的是 ( )
A. 正戊烷 B. 2甲基丁烷
C. 3甲基戊烷 D. 2,2二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铝土矿(主要成分为Al2O3,SiO2和Fe2O3等杂质)为原料制备铝氢化钠,铝氢化钠(NaAlH4)是有机合成的重要还原剂,工艺流程如下:
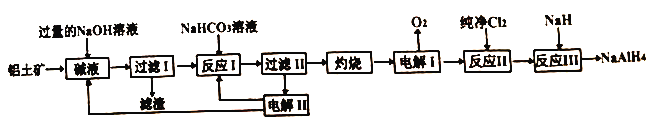 已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施是_______。(任写一种)
(2)电解I的化学方程式_______。
(3)“灼烧”操作用到的主要仪器有_______、_______、三脚架、玻璃棒、酒精灯、坩埚钳。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
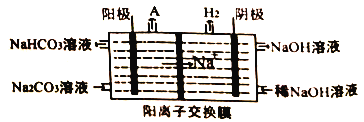
物质A为_______。(填化学式)
(5)反应III的化学方程式为_______,某同学经过分析认为可以再设计一个电解槽,电解_______ (填物质名称)溶液,更能实现副产物的循环利用。
(6)某同学认为该制备工艺也可以先酸溶,再加入NaOH溶液,当溶液中铁离子沉淀完全时,此时溶液pH是_______。(一般认为室温下离子浓度小于10-5mol/L时沉淀完全;Ksp[Fe(OH)3]=1×10-35,Ksp[Al(OH)3]=3×10-34)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com