
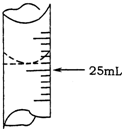
 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
分析 (1)根据滴定管的精确度为0.01mL,读出读数;
(2)先分析数据的可能性,误差太大的去掉,V(标准)取平均值,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$计算;
(3)根据待测溶液润洗锥形瓶,会使的待测液的物质的量增多;根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析误差.
解答 解:(1)记录滴定前滴定管内液面读数为1.10mL,滴定后液面如右图为24.90ml,滴定管中的液面读数为24.90ml-1.10ml=23.80mL,
故答案为:23.80mL;
(2)第二组读数误差太大舍去,标准液消耗的体积V(标准液)=$\frac{26.11+26.31-0.22}{2}$=26.10ml;根据c(待测)=$\frac{0.1000mol/L×0.0261L}{0.025L}$=0.1044mol•L-1;
故答案为:0.1044mol•L-1;
(3)A.锥形瓶用蒸馏水洗净后再用待测液润洗,待测液增多,消耗标准液增多,结果偏高,故A符合;
B.酸式滴定管用蒸馏水洗净后再用标准液润洗,符合实验操作,结果符合,故B不符合;
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失,读出的标准液体积增大,结果偏高,故C符合;
D.滴定前读数正确,滴定后俯视滴定管读数,读数减小,标准液体积减小,结果偏低,故D不符合;
故答案为:AC.
点评 本题考查了酸碱中和滴定操作、误差分析以及注意事项,热化学方程式的应用,难度不大,应注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17g甲基(-14CH3)所含的中子数为9NA | |
| B. | 42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA | |
| C. | 标准状况下,11.2L苯中含有的碳碳双键数为1.5NA | |
| D. | 5.6g铁与0.1mol氯气在点燃条件下充分反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴的四氯化碳溶液中,溶液褪色 | |
| B. | 苯滴加到溴水中,振荡后水层接近无色 | |
| C. | 将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生 | |
| D. | 甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1 mol CaC2、KHSO4、KO2(超氧化钾)三种离子化合物中,所含阴、阳离子的总数均为3NA | |
| B. | 0.1 mol C2H2OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [H+]=[OH-]的溶液 | B. | pH<7的溶液 | ||
| C. | [H+]=1.0×10-7mol•L-1 的溶液 | D. | [H+]>[OH-]的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com